ウイルス粒子 分譲サービス

ウイルス粒子 分譲サービス
ウイルスベクターより作製されたウイルス粒子(virus particle)です。ウイルスベクターを用いたウイルス粒子作製の工程が必要がなく、お手元に届きましたらすぐにご使用頂けます。
特長
- ウイルスベクターからウイルス粒子作製までの時間やコストを省けます
- タイター測定や遺伝子配列確認など、充実した品質管理
- レンチウイルス・アデノ随伴ウイルス(AAV)のウイルス粒子をご用意
レンチウイルス粒子
<特長>
- Trono labにより開発されたpsPAX2(addgene plasmid# 12260)とpMD2.G(addgene plasmid# 12259)を用いたパッケージングシステムを使用(パッケージング用細胞株はLenti-X 293Tを使用)
- 低速遠心及びそれに続く0.45umフィルター(polyethersulfone membrane)によりウイルス粒子を精製
- 高品質・高タイターのウイルス粒子をご提供
- バーコードにより、レンチウイルスベクターからウイルス粒子作製までを一元管理
<品質管理>
- 1. colony formation assayによるタイター測定(細胞株A549を使用)
*抗生物質耐性遺伝子をもつウイルス粒子の場合には、薬剤添加後、細胞増殖に基づいたタイター値測定も追加
*蛍光タグをもつウイルス粒子の場合には、直接蛍光法による測定も追加
*タイター値はバイアル作製後、一旦凍結させたものを再融解させた後測定 - 2. マイコプラズマ感染チェック
*パッケージング用細胞株(Lenti-X 293T)及びタイター測定用細胞株(A549)の感染チェックを実施
*バイアル融解後、2~3週間培養した後、マイコプラズマのコンタミネーションの有無を確認
*マイコプラズマ感染の確率を減らすため、使用する細胞株は継代数は15回までとし、都度新しい細胞株に交換 - 3. Transfer plasmidの配列確認
*作製されたウイルス粒子をテンプレートとしてPCRを行い、transfer plasmid中のターゲット領域の配列確認を行う。
例)lentiCas9-Blast(addgene plasmid No. 52962)
確認用として、以下のプライマーを使用
Forward Primer: dCas9-F2 CCAAAGAGGTGCTGGACG
Reverse Primer: Blast-R GCTCTTTCAATGAGGGTGGA - 4.タンパク質の発現確認(一部商品のみ)
例)lentiCas9-Blast(addgene plasmid No. 52962)
*ウイルス産生に使用するプラスミドは、endA-mutated NEB Stable strainにて、増殖させ、エンドトキシンフリーのプラスミド抽出キットを用いています。
<商品ラインナップ>
- Pooled CRISPR Lentiviral Libraries
- Cas9 and CRISPR-activator Viruses
- gRNA Viruses
- Non-CRISPR Viruses 等
今後、新しい商品も追加されていく予定です。
<関連ページ>
アデノ随伴ウイルス(AAV)粒子
<特長>
- 3つのプラスミド(1. transfer plasmid, 2. rep及びserotype-specific capをコードしたplasmid, 3. adenoviral helper配列をコードしたplasmid)によりウイルス粒子を作製(パッケージング用細胞株はHEK293を使用:プロトコル)
- イオジキサノール密度勾配遠心分離法によりウイルス粒子を精製
- in vivo研究に十分な精製度及び高タイター値のウイルス粒子をご提供
- バーコードによりアデノ随伴ウイルスベクターからウイルス粒子作製までを一元管理
<品質管理>
- 1. real time qPCRを用いたタイター測定
(ターゲット領域はInverted terminal repeat:ITR)
*real time qPCRやタイター値測定時には、コントロールとしてATCC AAV reference materialを使用
*タイター値はバイアル作製後、一旦凍結させたものを再融解させた後測定 - 2. Transfer plasmidの配列確認
*作製されたウイルス粒子をテンプレートとし、PCRを行い、transfer plasmid中のターゲット領域の配列確認
*DIOやFLEXプラスミドについては、2つ以上のプライマーセットを用いて、ベクター内のカセットの向きを確認 - 3. 次世代シークエンスによりウイルスゲノムの配列確認
*最終産物であるウイルス粒子から単離したウイルスゲノムを次世代シークエンサーにより配列確認
*マイコプラズマなどの他のDNAが混入していないかも確認 - 4. アデノ随伴ウイルス粒子の精製度を確認
*キャプシドタンパク質であるVP1, VP2, VP3の相対的な化学量論比の比較によりアッセイを行っている。具体的にはウイルス粒子をサンプルとし、ポリアクリルアミド電気泳動(PAGE)、それに続く銀染色により、キャプシドタンパク質の分子量及びバンド強度を確認し、精製度を決定 - 5.ウイルス粒子の感染能を確認
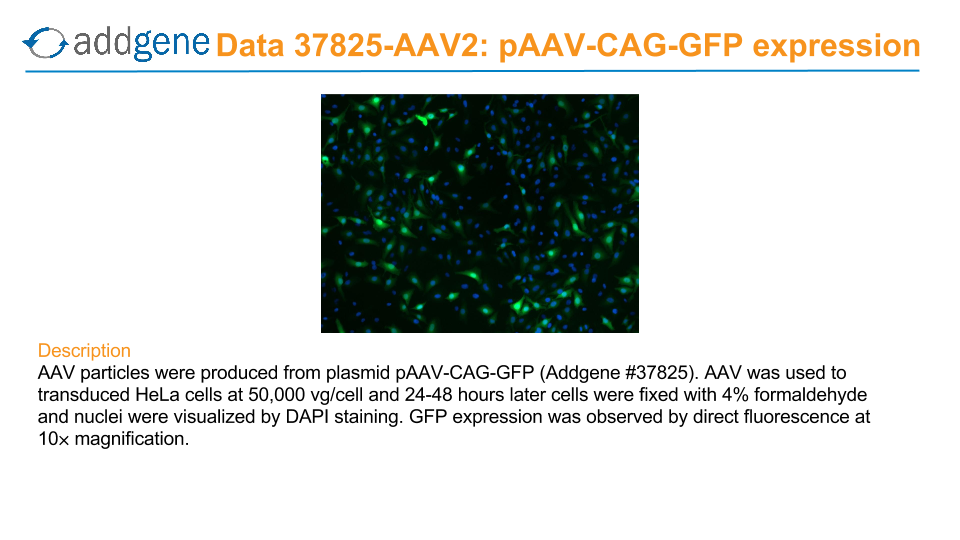
*ウイルス導入効率の確認のため、一部の商品で、in vitroでのレポーター遺伝子発現をテスト
*レポーター遺伝子発現を示す蛍光顕微鏡画像はウェブカタログに掲載
例)pAAV-CAG-GFP(addgene plasmid#37825)
<商品ラインナップ1. カタログ掲載品>
すぐに注文可能な商品です。ウェブカタログからご希望の組換え用プラスミド(Transfer Plasmid)と血清型(Serotype)をお選びください。
商品一覧はこちら
※「Function」または「Serotype」の各カテゴリーに分類されています。各カテゴリーをクリックすると、登録されたプラスミドの一覧が表示されます。
<商品ラインナップ2. リクエストサービス> NEW
ウェブカタログにご用意のないAAVウイルス粒子の作製サービスです。
4,000種類以上の組換え用プラスミド、7種類の血清型から選択し、28,000通り以上の選択肢の中からご希望のウイルス粒子を作製することができます。
以下の3点をお選びください。
a ) 組換え用プラスミド: 対象プラスミド一覧はこちら
b ) 対象血清型: AAV1, AAV2, AAV5, AAV6, AAV8, AAV11, AAVrg
c ) 容量: 0.2mL(100μLx2本)、1mL(100μLx10本)、2.5mL(100μLx25本)、5mL(100μLx50本)
※研究用途のみご利用いただける商品となります。
※ご希望内容によっては提供ができない場合がございます。
※カタログ掲載品よりも納品までにお時間を頂戴します。標準納期は、8~10週間(AAV作製期間(最短6~8週間)+通常納期(MTA締結後、約2週間)となります。作製状況等によって納品までに追加の期間が必要となる場合もございます。あらかじめご了承ください。
<関連ページ>
ATCC トランスフェクション試薬
ATCCよりトランスフェクション試薬が新たに販売開始となりました。Addgeneプラスミドの細胞への導入にぜひお試しください!
価格
| 種類 | 価格(税抜) |
|---|---|
| addgene Virus 商品 |
※2019年3月1日(金)より、一部addgene Virus商品に数量割引を設定致しました。
ご購入にあたって
※ウイルス粒子には、必ずウイルス粒子作製の元になったウイルスベクターが付属します。
 創薬支援サービスはこちら細胞・ヒト組織商材についてはこちらのページで紹介しております。
創薬支援サービスはこちら細胞・ヒト組織商材についてはこちらのページで紹介しております。