一般的な培養手順について
|
|
Q
培地と添加物
A
粉末および液体培地の組成成分表はホームページ上などで通常公開されていますので容易に入手が可能です。一般的に良く使用されているHam’s F12培地やDMEM, RPMI1640, MCDB培地 および、これらの組み合わせからなる基礎培地は、トリプシン-EDTAやPBSなどと同様に、様々な製造元から入手することが可能です。市販の調整済み培地を使うかどうかは、研究者の方が予算や製品の品質、およびその製品自体を信頼されるかどうかにより異なります。特種な培地は、特別注文品として入手することも可能ですが、大量のオーダーとなるのが一般的です。(例えば100Lもしくはそれ以上のスケール)。
液体培地は出荷前の段階で保存されている期間がすでに経過していることから、液体培地として購入されるよりもより粉末状態から調整される培地のほうが良いでしょう。研究室でお手持ちの試薬類で自家調整される場合には、保存期限や溶解性について理解しなければならないため、これらの試薬類について報告がなされているオリジナルの論文を参照して調整しなければなりません。細胞培養用試薬のいくつかは、標準グレードの安価なものと、"cell cultureグレード "もしくは "tested for cell cultureグレード"と記載されている高価なもの、といったように、2種類のグレードのものがカタログに掲載されており、後者の記載がなされている製品のほうがより良いと言えます。これは、あまり近年問題になってはいないようですが、たとえば初期の工業的な大量生産がおこなわれていた際供給されていたHEPESバッファーで、細胞毒性を示す物質の混入レベルが一定でなかったことがありました。少なくとも、試薬グレードで供給されている商品を使用していただくべきであり、これは例えばpH調整のために使用する塩化ナトリウムや水酸化ナトリウムが低品質の商品であった場合に、鉛の混入レベルが細胞に対する毒性となり影響を与えることがあるからです。
細胞培養用の全ての試薬調整において、HPLCグレードの水を使用されることを推奨いたします。HPLCグレードの水を精製できるフィルタ-装置はたくさん市販されており入手が可能となっています。ガラス蒸留装置で3回蒸留を行った水でも可能ですが、3日以内に使用してください。藻類はどこにでも成育することができ、その藻から他の微生物が栄養を取る、というように生態系はとても早く発達してしまうので、長期間保存していた精製水は使用しないでください。 大容量でフィルタ-精製する場合、ポンプもしくは圧力をかける装置を使用することが可能です。この装置の使用にはある程度の設備または滅菌を必要としますが、濾過する培地量が一般的には4リットルを上回るかどうかで使用する価値があるシステムであるかどうかを判断します。または、消耗品として市販されているプラスチック製のフィルタ-システムを使用することも可能です。
血清はいくつかの会社から入手することが可能で、バッチごとに変化するのが一般的です。このため、ご使用される細胞に対し、事前確認試験のためバッチごと血清の評価を実施するということは一般的な作業であります。 血清は-70℃~-90℃であれば長期保存することが可能です。いくつかの血清ロットにおいては、一般的な構成成分の分析結果が付与されていますが、もちろん分析されていない構成成分も存在し、これらについては示されてはいません。ます。血清も含めた市販の試薬類などの滅菌性については、疑いを持ってお取扱いいただくほうが良いでしょう。
血清を含む培地を使用する場合、ご自身で濾過して作成しておいた無菌であろうと思われる血清を培地添加されるより、念のために使用される直前にフィルター滅菌して用いると安全です。濾過滅菌後の培地を確認するため、抗生物質が添加されていない大容量培地、もしくはLB寒天培地にその培地を少量入れて数日間培養することで、滅菌性試験を実施していただくことが可能です。一般的には、可能であれば100-200ml容量の容器に液体培地を保存しておくことを推奨いたします。血清を含むほとんどの培地がこのように保存可能ですが、無血清培地の場合にはCa+, Mg+が高濃度に含まれるため、凍結時に沈殿物が産生されてしまいます。
冷蔵保存されていた液体培地は、37℃のウォーターバスで10-15分程度温めてください。もし凍結されている状態であれば、培地を解凍機能に設定した電子レンジ波で2~3分間解凍することも可能です。超低温で保存されていたガラスボトルの血清を溶解する場合には十分ご注意ください。ボトルの破裂を防ぐため、まずガラスボトルは-20℃で2時間置き、その後4℃で1時間置き、続いて37℃のウォーターバスで溶解するようにして下さい。細胞培養に使用される全ての試薬類は、細胞に加える前に温めた状態で長時間放置せず、最低限に留めてください。
過去20年間の細胞培養技術の革新により、血清の代わりに精製された成長因子やホルモンが添加されるようになりました。いくつかのホルモンが市販されており、比較的安価に購入することが可能ですが、その他、特にペプチド成長因子については従来から高価でした。組換え体やペプチド合成における近年の大量生産技術の進化により、これらの価格は下がってきました。これらの添加物は一般的には後々培地に加えて使用するまでは濾過して保存しておくべきであり、血清のように培地に直接加えて保存すべきではありません。安定性の問題により、ほとんどの無血清培地用の添加物は高濃度で保存されている溶液の状態で、細胞播種後の個々の培養プレートやフラスコに対して、その使用培地容量に相当する量を直接添加するほうがよいと言われています。成長因子ペプチドのほとんどが滅菌された乾燥粉末の状態で市販されており、滅菌水もしくは供給元が指定する塩化バッファーで膨潤して使用することが可能です。ほとんどの添加物は凍結状態で長期保存が可能ですが、繰り返しの凍結融解は避けてください。
|
|
Q
Media and reagents
A
Powdered and liquid media formulations are available commercially. Commonly used basal medium formulations such as Ham's F12, Dulbecco-modified Eagle's medium, RPMI 1640, MCDB media and combinations of these media, as well as sterile solutions of trypsin-EDTA, PBS etc. are available from multiple sources. The degree to which an investigator chooses to use commercially-prepared solutions depends on budgets and the degree of faith in the quality and consistency of the product. Unusual medium formulations can be obtained by special order, but usually in large lots only (eg., 100 liters or more).
Making media fresh from a powdered formulation is preferable to buying liquid media, because the liquids have undergone a period of storage prior to shipping. If medium is made from laboratory chemicals, it is imperative that the original papers reporting these formulations be consulted, because an understanding of storage stability and solubility of stock components is essential. Some cell culture-related chemicals appear in catalogues in two grades: a cheaper standard grade and a more expensive "cell culture " or "tested for cell culture" grade. This issue may have some merit; for example, early industrial batches of HEPES buffer, were inconsistent in levels of contaminants toxic to cultured cells, but this particular problem has not been of recent concern. At the least, reagent grade materials should be used; contaminating levels of lead, for instance, in poor quality NaCl or NaOH used for adjusting medium pH can contribute to cell toxicity.
For all cell culture reagents, HPLC-grade water is recommended. A number of filtration systems to produce HPLC-grade water are commercially available. Triple glass distillation is also fine, but less used these days. Storage of water purified earlier is not recommended, because even minimal microbial growth upon storage can lead to pyrogen contamination of the water. Algae can grow anywhere, and an ecosystem in which other microorganisms benefit from the algae can quickly develop. For large scale filtration, pump-driven or pressure-driven devices are available. These require some degree of assembly or sterilization and might be considered worthwhile of if the volume of medium to filter routinely exceeds 4 liters. Otherwise, disposable, sterile, plastic vacuum filtration devises may be used.
Serum is available from multiple companies, and batch to batch variation is the rule. It is common practice to request prior to purchase samples of various serum batches for testing with the particular cell system of interest. Serum can be stored long term at -70 to -90oC. Some serum lots are provided with an analysis of components of presumed general interest; of course this gives no insight regarding the components that are not assayed. It is recommended that sterility of any commercial solution, including serum, be treated with skepticism.
In situations in which serum-containing medium is used, a relatively safe approach is to filter the serum-containing medium as the last step, rather than adding presumed sterile serum to medium you have filtered. Medium can be tested for sterility after filtration by inoculation of a small volume into a larger volume of antibiotic-free medium and incubation for a few days, or by inoculation onto antibiotic-free LB agar plates. In general, it is recommended to store liquid medium frozen in 100-200 ml aliquots if possible. Most serum-containing media can be stored this way, but some serum-free media can precipitate upon freezing because of relatively high calcium and phosphate concentrations.
Liquid medium stored in the refrigerator may be warmed in a 37oC water bath for 10-15 minutes. If frozen, medium can be thawed in microwave for a few minutes on defrost setting. Glass bottles of serum stored at very low temperatures can present a problem when thawing. To prevent breaking the bottle, first place bottle at -20oC for 2 hours, then 4oC for 1 hour, then into a 37oC water bath. It is good practice to minimize the time any cell culture reagent is maintained in a warm environment prior to exposing to cells, because some of the relevant components are heat sensitive
Advances in cell culture in the last two decades have been made by supplementing or replacing serum with purified growth factors or hormones. Although some of the hormones are relatively cheap commercially, others, particularly the peptide growth factors, traditionally have been quite expensive. Recent progress in large scale production of recombinant products and peptide synthesis has led to price reductions for some of these. Unlike the approach one might routinely take with a serum supplement, these supplements generally should not be added directly to the medium, filtered and then the medium stored for later use. Stability problems dictate that most serum-free supplements are best added directly to medium in individual plates or flasks as small aliquots from concentrated stocks immediately after plating cells. Many peptide growth factors may be obtained as sterile, lyophilized powders from commercial sources and re-constituted with sterile water or buffered salt solutions as indicated by the vendors. Store sterile stock solutions of supplements in the refrigerator. Supplements may be stored long-term in the freezer in aliquots. Multiple freeze-thaws should be avoided.
|
|
|
Q
細胞培養用のプラスチック容器とガラス容器
A
予算があるならば、使い捨てのプラスチック製容器を使用してください。特に無血清培地で培養しなければならない細胞は、研究室の予算が許す限りプラスチック製の使い捨てタイプ容器を使用されることを推奨します。これは、ガラス容器専用の市販の洗剤は存在するものの、そのガラス容器を再利用した際に残在した溶剤が細胞に対し毒性を示すので、再現性が保証できるまで十分に洗浄するためにはかなりの労力と時間がかかる作業であるからです。 市販のプラスチック製培養容器は、接着もしくは初代培養用の細胞などの用途に用いられるため、化学的もしくは物理的な機能を有するように表面加工がなされています。これら容器はそれぞれの細胞培養システムに対して試験がなされています。しかしながら、これら細胞培養用の容器は、出荷の際や製造の段階において稀にダメージを受けていることがあり、視覚的に簡単に判別することができないことから、ある程度の品質に対する信頼性にも疑問が生じることもあります。もし微生物のコンタミがあった場合には、プラスチック容器自体の汚染原因も考慮に入れるべきでしょう。メーカーから市販されているプラスチック容器では、時々ほとんどの用途ではほぼ問題なく使用することが出来たのに、あるいくつかの細胞にとっては予測しなかった影響を与えるという変化もあるようです。
個別包装された滅菌済み綿栓プラスチックピペットは、細胞培養用のクリーンベンチ内での無菌作業には必要不可欠ですが、必要時にのみ使うべきであることを研究所のメンバーに対して認識してもらうことはコスト面において有効でしょう。滅菌された状態が必要ない作業では非包装のプラスチックピペットやガラス製の使い捨てピペットの使用が可能です。またこれと同様に、ピペットのサイズによりコストが異なるので、適切なサイズのピペットを使用することも効果的です。使い捨てのガラス製滅菌済み綿栓パスツールピペットは、価格も安く少量の作業の際にも使い勝手が良いでしょう。培地を作成した際に使用されたフラスコやシリンダー、混和棒、培地を保存していたガラスボトルなどは、使用後は直ぐにすすぎ洗いし、洗剤は使用せずにHPLCグレードの水で洗浄してください。細胞培養用に使用されるガラス容器は、過去に他の用途で使用されていないものを用いるようにしてください。 |
|
Q
Cell culture plasticware and glassware
A
It is recommended to use plastic, disposable cell culture materials as much at the budget will allow. This is particularly true for serum-free cell culture. It is difficult and time consuming to wash reusable glassware sufficiently free of toxic detergent to guarantee reproducible success when using these in cell culture, although detergents sold commercially for use with cell culture glassware improve this situation. Some commercially available plasticware is advertised to have been chemically or physically altered to improve certain functions, such as adhesion or growth of primary cultures; these must be tested individually for each cell culture system. Cell culture vessels occasionally are damaged in shipping or improperly manufactured so that integrity is compromised in a way that is not immediately obvious visually. If microbial contamination suddenly appears, do not discount the possibility that the plasticware is faulty. Plastic formulations used by the commercial suppliers may change from time to time in ways that may be insignificant for the vast majority of user but may have unpredicted effects for some cell culture systems.
It may be useful to impress upon laboratory personnel that sterile, cotton-plugged, individually wrapped plastic pipettes are essential for sterile work in the cell culture hood, but should only be used when necessary. Unwrapped plastic pipets or glass disposable pipets are available for nonsterile manipulations. Similarly, the appropriate pipette size should be used, because cost goes up with increasing size of the pipette. Sterile, disposable, cotton plugged glass Pasteur pipettes are cheap and extremely versatile for small volume work. It is recommended that flasks, graduated cylinders, stir bars, etc. used in making up medium and glass bottles used to store medium be rinsed immediately after use and washed with HPLC-grade water without soap. Glassware used for cell culture work should never have been used previously for other purposes. |
|
|
Q
研究室で使用する常備品と、ルーチンの手技
A
研究室のウォーターバスは常に細かく正確な温度で調節されている必要はなく、研究室で通常使用されているもので十分です。また、研究室のウォーターバスは、コンタミネーションの原因として最も多い汚染源の一つであることから、定期的に洗浄し抗菌用剤を添加しておくべきでしょう。無菌のクリーンベンチ内で溶解するか、溶解した後70%のエタノールをスプレーしてからクリーンベンチ内に入れるようにしてください。細胞培養室のウォーターバスが37℃から変わらないようにするため、サーモスタットをウォーターバスに入れておくことも安全策として有効です。電子レンジや自作のドライウォーマーでも結構ですが、電子レンジを使用する際には加熱しすぎないよう注意が必要です。細胞の遠心回収の際には、通常、冷却機能のない卓上遠心分離機を使用します。研究者は通常、同時並行で他の作業をすることが多いので、タイマー付きの遠心機を使用すると良いでしょう。細胞培養用の研究室では、超低温フリーザーが使い勝手が良く、また霜取り機能付きの一般家庭用の冷凍冷蔵庫は使用するべきではありません。冷凍庫の湿度は出来る限り低くするべきでしょう。
培養上清を廃棄する際には、ピペットに廃液を排出するためのチューブを接続し、チューブの一方を1-2Lサイズの廃液瓶に差し込み、廃棄物が不活性化されるように、予めVIrex50mlを入れておいてください。また、その廃液瓶が陰圧となるよう、家庭用吸引機や小さいポンプを接続しておくと便利です。なお、揮発性の漂白剤はポンプが腐食しますので、廃液フラスコには漂白剤を入れないでください。細胞培養用に使用した使い捨てプラスチックピペットや他の培養容器は、バイオハザードバッグに廃棄してオートクレーブ処理してください。バイオハザードバッグをオートクレーブで処理する際、上部を完全に結束せず、またテープで、完全に密封しないよう注意してください。袋の内部に圧力がかからないようにゆるく余地を残して、上部を軽く丸め込んでテープで留めてからオートクレーブにかけてください。
オートクレーブには、家庭用の圧力鍋による蒸気滅菌が使用されていますが、このような手法では、それ自体が汚染されていることが多いことから、脱イオン水から出る蒸気で滅菌するオートクレーブを使用することを推奨いたします。汚染された蒸気は、ガラス製の表面に汚れが付着するので目視で確認することができます。その他、オートクレーブ処理のルールとしては、オートクレーブテープを使用しても滅菌性(特に大量の液体を処理する場合)は保証されないこと、窯の容量一杯に詰め込まないこと、ガラスのビンは板の上に置くこと、滅菌する容器を密閉してオートクレーブ処理しないこと、容器一杯に内容物を入れてオートクレーブ処理しないこと、などがありますので十分ご注意ください。 |
|
Q
Routine laboratory equipment and procedures
A
Routine laboratory water baths are fine, and precise temperature control is usually not necessary. Water baths are a major source of contamination in a cell culture laboratory, and should be periodically cleaned and antimicrobial detergent added. After warming or thawing a container that will end up in a sterile hood, spray it down with 70% ethanol and wipe clean before placing into hood. Secure the thermostat setting on water baths located in tissue culture rooms so that they cannot be easily changed from 37oC. Microwave ovens and custom-built dry warmers are also fine, but care must be taken not to over heat with the microwave oven. Bench-top, clinical centrifuges without refrigeration are generally used for routine cell centrifugation. Centrifuges with timers are preferred, because the investigator is likely at the time of centrifugation, to be doing several things at the same time. A low-temperature freezer is extremely useful in a cell culture lab. Self-defrosting freezers should be avoided. Refrigeration should be in as dry an atmosphere as possible.
A vacuum flask hooked to house vacuum or a small vacuum pump and containing a decontamination solution (eg., 50 ml virex in a 1 or 2 liter flask) becomes convenient for removing medium from culture dishes when connected to a tube with a pipette on the end for removing the medium. Do not use bleach in the vacuum flask; the volatile bleach will destroy the pump. Disposable plastic pipets and other culture-ware contaminated with live cells should be disposed of in biohazard bags and autoclaved. To make biohazard bags ready for autoclaving, do not completely seal by tying or taping top shut. Loosely fold top over and tape, leaving room for pressure exchange.
House steam is commonly used for sterilization by autoclave. Such a source can be quite dirty, and an autoclave that generates its own steam from deionized water is recommended. Dirty steam may be obvious as a layer of scum on autoclaved glassware. Otherwise, the usual rules of autoclaving apply: using autoclave tape doesn't guarantee sterility (especially with large volumes of liquids); don't pack the autoclave completely full; place glass bottles in a pan of water; don't seal containers before autoclaving; don't autoclave full containers. |
|
|
Q
細胞培養用のクリーンベンチ
A
細胞や、培池、培養容器を扱うための無菌操作には、クリーンベンチフードが必要不可欠である、と長年に渡る細胞培養技術により認められています。水平層流型のフードは、フィルター滅菌された空気が作業スペースを通って作業者対してダイレクトに吹きつけるように流れることで作業エリアを無菌に保つ簡便な装置です。フード内に気流を妨げるものがある場合、その機能は失われてしまいます。適切なフードの使用が気流効率に影響を与えることから、滅菌作業のためフード内でバーナーを使うことは、一般的に適切であるとは言えません。また、空気の流れが早いと培地が重炭酸塩のみのバッファーで作成されている場合、急激にアルカリ性に傾いてしまう原因になることがあります。水平流層フード内において発生した蒸気やこぼれた液体は噴き出することがあり、これらの危険性から作業者は保護されているわけではないことから、微生物汚染の有無が確認されていないヒト由来の形質転換細胞や、放射能を有する溶液や、有毒な揮発性溶液をフード内で扱うことは賢明であるとは言えません。フード内での適切な作業とは、濾過滅菌や毒性のない溶液の分注、作業エリアでの顕微鏡を用いた無菌顕微解剖、および「安全である」と想定される細胞の培養などが相当します。
ラミナ―フローフードとは滅菌された空気のカーテンが作業者の前面で垂直に吹き下ろすダウンラミナーフローを利用した装置です。通常、作業者が作業スペースに手を差し込める程度にガラス製の障壁が下げられ、作業者とフード内部を隔てるようになっています。一般的に使用されているラミナ―フローフードは、フィルター濾過された空気のある分画だけを噴き出すようになっており、また排出された空気は室内へ戻されて循環するようになっています。この特徴により、設置された部屋自体をより滅菌された環境にしたり、またフードフィルター自体の寿命を引き延ばすこともつながるメリットをもたらします。シンプルなフードを使用する場合、不必要なものをフードの作業エリアに入れることにより滅菌性が悪くなります。特定のデザインのフードは米国国立衛生研究所の策定した安全性標準仕様を満たすように造られているため、一般的には機能を比較して選ぶことが可能です。これらのフード内で殺菌用のバーナーを使うことは可能ですが、製造元のメーカーはバーナーが気流を乱すので、フードの作業エリア内で減菌性が悪くなると警告しています。もし炎を使用するのであれば、必要時にのみ大きな炎に調節できるようなガスバーナーを使用してください。作業中に手を使わずにすむように、足のペダルでリモートコントロールが可能な電子着火式バーナーなどがあります。
バーナーの場合は特に、ガス管やリモートコントロールの装置が故障した場合、ガスによる火事が起こりえます。引火を防ぐためには、フード内部にあるバーナーに対し配管されているガス管をきつく繋ぐようにしてください。ほとんどのフードでは作業スペース内部にガスを遮断するバルブがあります。作業エリア内に炎がある場合にはこのデザインは使えません。ガスの元栓がフードの外で簡単にアクセスできる場所にあるタイプがより良いデザインと言えるでしょう。細胞培養フードには、培地除去の用途や減圧濾過のために住宅用の真空装置が接続されています。また、真空ポンプの遮断バルブは通常フード内の作業エリアに置かれています。真空バルブが開いた状態でガスバーナーから炎が出ていると、最も回避するべき怪奇現象が引き起される可能性があります。卓上のガスの炎と違い、細胞培養用のフード内部では炎の周辺の空気の流量が増大するため大惨事が引き起こされる可能性があります。
実験室の滅菌環境を維持するために、使用していない時でも常にフードを運転中にしておく研究者もいれば、モーターとフィルターの寿命を節約するために使用していないときには電源を切る研究者もいます。これらの違いは、100%排気のフードを使用する場合と、バイオハザードを扱う場合に重要となりますが、絶えず最も安全な状態が維持されていることこそが重要で、推奨であるといえます。どんな培養物であっても原理的にはヒトに対する病原微生物に感染している可能性があることから、"安全な培養物"とは、各研究者により定義されてはいるものの、人に由来する材料は一様に危険性を有するものとして考慮すべきです。安全を考慮した状態であったとしても、手で持つタイプの自動ピペット装置は必要不可欠です。小型でフード内に置いておくのに最適なタイプが最も人気が高いようで、フード内の滅菌された空気を吸引し排出する点や、様々なサイズのピペットを脱着可能であることなどがポイントの様です。家庭用電源で駆動するタイプと、電池式駆動タイプのモデルから選ぶことができます。
研究者の中には、ラミナ―フローフードの使用によりフード内の作業エリアでは通常の滅菌操作として原則とされるテクニックを必要しないのではないか、といった間違った安心感を持たれている方がいます。フードのガラス障壁の下側に開いているスペースは作業のための手を挿入するために設計されてはいるものの、望ましくない物も入りこんでしまうこともあります。フード内での作業やガラス障壁越しの視界の悪さから、研究者はフードに頭の一部もしくは全部を入れてしまうこともあります。いくつかの観点からこれは望ましい行為とは言いかねます。
他に問題となるのは、単純にガスや吸引装置が利便性良く配管されていることから、ラミナ―フローフードを使用するレベルの防御を必要としない用途に使ってしまう個々人の傾向です。もし十分な管理がなされていない場合、薬剤耐性菌やカビ培養物を含め、研究所に存在する非滅菌株はフード内でも生育できる環境を見出すかもしれません。これら各種の理由から、使用前にフード内を70%エタノールでスプレーし、拭き取ることをお勧めします。特に長髪や、あごひげ、可燃性の衣服などをお召しになっている場合には、バーナーに火をつける前に数分間フードを試運転させて置くようにしてください。
|
|
Q
Cell culture hoods
A
Answer: A commitment to cell culture techniques over the long term requires a hood that provides a sterile environment for manipulation of cells, solutions and culture vessels. Horizontal flow hoods are simple devices for maintaining a sterile working area in which filtered air is blown through a contained space directly at the investigator. Anything in the hood that impedes air flow compromises the capability of the system. To operate properly these hoods require a substantial air flow rate, and it usually is not feasible to use a burner to provide a sterilizing flame in these hoods. The high air flow rate also often contributes to rapid alkalization of culture medium that is buffered with bicarbonate only. It is not wise to work with poorly characterized transformed human cells, potentially infectious microorganisms, radioactivity or toxic or volatile solutions in horizontal flow hoods, because the investigator is unprotected from vapor or liquid droplets that might be generated in the hood and then blown out. Appropriate tasks for horizontal hoods include sterile filtration or dispensing of nontoxic solutions, sterile microdissections requiring a microscope in the work space, and culture of cells considered "safe".
Laminar flow hoods utilize a sterile air curtain blowing vertically in front of the investigator, usually with a glass barrier between the investigator and the hood work space below which is an opening for the investigators hands to enter the work space. The commonly used laminar flow hoods exhaust a fraction of the air through a filter and back into the room, and recycle the rest. This feature has the added attractions of producing a more sterile environment in the room itself and prolonging the lifer of the hood filters. As with the simpler hood types, cramming unnecessary stuff into the hood work-space will compromise sterile operation. Most hoods of a particular design are generally comparable in functionality, because all are built to satisfy standard specifications developed by the National Institutes of Health. It is possible to use a sterilizing flame in these hoods, but manufacturers warn that the flame disturbs the air flow and may thus jeopardize sterility in the hood work-space. If you choose to use a flame, one approach is to use a gas burner with a pilot flame that can be activated to the full flame when needed. Remote control foot pedals are available for these burners, freeing the investigators hands during operation.
Gas fires can occur in these hoods, especially if the burners, tubing or remote control devices malfunction. Inflammable, gas-tight tubing is recommended for connecting the gas outlet inside the hood to the burner. Many hoods have gas cutoff valves inside the work space. This design is of little use if the fire is also inside the work space. A better design includes an easily accessible gas cutoff valve outside the hood. House vacuum also is routinely plumbed into cell culture hoods to facilitate medium removal and vacuum filtration, and the vacuum cutoff valve is also routinely placed inside the hood work-place. The combination of an open vacuum line and a gas fire inside a contained hood space can create some interesting phenomena that might be best avoided. A gas fire in a cell culture hood may represent a larger danger than a comparable bench-top gas fire because of the increased air flow in the vicinity of the fire.
Some investigators leave hoods running constantly, helping to maintain a sterile environment in the general laboratory, others turn them off when not in use, conserving the lifetime of the motor and filter. These issues only become critical with 100% exhaust hoods and biohazardous work, in which it is recommended that the safest mode be maintained constantly. "Safe cultures" must be defined by each investigator; any culture could in principle be contaminated with a potential human pathogen, and human-derived material is considered by some to represent a risk uniformly. Even under presumed safe conditions, a hand held pipeting device is essential. The most popular style is small enough to be placed inside the hood, so it draws in (and therefore pushes out) sterile air, and various sizes of pipettes can be attached. These are available as both house current-driven and battery powered models.
Laminar flow hoods may introduce a false sense of security to the point that an investigator may conclude that the normal rules of sterile technique need no longer apply inside the hood work-space. The open space at the bottom of the hood window is designed for insertion of hands, but it will also allow the insertion of other, less desirable appendages. Difficulties in manipulations inside the hood space or impeded view through the hood glass may lead one to stick all or part of one's head inside the hood. This is undesirable from a number of points of view.
Another problem is a tendency of personnel to use the laminar flow hood for procedures in which this level of protection is not needed, simply because it is conveniently plumbed with gas and vacuum. If sufficiently unsupervised, the most unsterile of laboratory components, including antibiotic resistant bacterial or fungal cultures, could find their way into the hood. For these and other reasons, it is advisable to spray the inside of the hood with 70% ethanol and wipe away the excess before hood use. Allow the hood to run for a few minutes after this before you light the flame on the burner, especially if you have long hair, a beard or flammable clothing. |
|
|
Q
顕微鏡
A
倒立位相差顕微鏡が必須で、予算が許す限り上位機種の使用を推奨いたします。いくつかは硬い金属製の安定な外部可動部に潤滑油を要するタイプです。他のデザインでは、より柔らかい金属円盤製で日々の作業による摩耗により装置から生じた金属粒子のために潤滑油を要するタイプもあります。これらは、最終的には重力に対するセットポジションを維持する能力を失うか、不正確な設定になってしまうでしょう。これまでは、レンズや他の部品を製造メーカー間で相互交換することが可能であり驚くほどでした。今ではこの状況は逆転し、ある顕微鏡メーカーから出されたモデルはその機種専用のレンズでしか使えず、その同じメーカーから以前に出されていたモデルにさえ交換できない状況となってしまいました。 |
|
Q
Microscopes
A
An inverted phase microscope is essential, and the best one that the budget allows is recommended. Some are designed to require external lubrication of moving parts; these are made of hard metal and last longer. The other design is made of softer medal and relies for lubrication on small particles of metal scuffed from the apparatus by everyday movement. Eventually these models loose the ability to maintain a set position against gravity or become imprecise in settings. Previously, specifications were sufficiently common among manufacturers that lenses and other parts were interchangeable to a surprising degree. This situation has reversed in recent years to the point that lenses for some models from a single microscope manufacturer are not exchangeable even with earlier models from that manufacturer. |
|
|
Q
液体窒素タンク
A
細胞を凍結保存するための液体窒素タンクは大小様々で、液体窒素の容量を自動で測定したり、自動で補充する機能が付いたものが市販されています。小さいタンクのほうが細胞を回収し易い利点はありますが、液体窒素を維持できる期間は短く安全とは言えません。細胞は液体窒素タンクの気層中で保存すべきであるとの議論がなされています。これは、液体窒素がバイアルに入り込んだ場合、バイアルを溶解する際に暴発する恐れがある事や、液体窒素中に存在する微生物によるコンタミネーションの原因になるということなどの理由があるからです。液体窒素が少ない場合、タンクが温まりやすく蒸散し易い状況であるためにこれら注意点と、それぞれのタンクのメリット、デメリットを充分に比較考慮して選ぶ必要があります。
|
|
Q
Liquid nitrogen tanks
A
Liquid nitrogen tanks for storage of frozen cells vary from relatively small to very large, with and without automatic nitrogen level sensing and filling capability. It is easier to retrieve cells from small tanks, but they are less conservative of liquid nitrogen. It has been argued that cells should be stored in vapor phase nitrogen above the liquid. Advantages are that the vials are less likely to fill with liquid and then explode when warmed up, and that cross contamination of vials by microorganisms via the liquid is minimized. These advantages must be weighed against the greater potential for the tanks to go dry because little liquid exists in the tank to compensate for warming. |
|
|
Q
インキュベーター
A
最もシンプルで信頼性のあるCO2インキュベーターは、水流ジャケットチャンバー式で取り外しのできる棚板が内蔵され、ガスの供給調節弁、水を入れておく金属トレイ、水流ジャケットヒーターと、高温を防ぐサーモスタットが装備されているものが良いでしょう。棚と枠は滅菌するために取り外しができるようになっているべきで、金属トレイには常に抗菌剤を加えておくことが重要です。さらに上位機種になると、ガス供給や湿度レベルを自動調節するためのセンサーや、銅製の壁、チャンバー用送風機、チャンバー内部の個々の間仕切り、などの付属機器類が市販されています。結局、CO2センサーやコントロール装置はガスの節約につながるものの、CO2の費用の大部分を占めるのがシリンダーのレンタル費用なので、期待するほどの効果ではないでしょう。インキュベーター内の湿度や温度は底部から上部に向かって傾きがあるため、温度変化に敏感な変異体を使って作業する場合などではインキュベーター内部の送風機を使用することで細かい温度調節が有効になります。チャンバー内の送風機能のデメリットは、空気の循環が増すことにより、インキュベーターを通じて微生物汚染が拡がってしまう可能性があることです。(Copper式インキュベーターの壁は抗菌性があると言われていますが、高価です。)通常ローラーボトルやスピナーフラスコで用いる水流ジャケットのないインキュベーターでは、一般的には送風機能はありますが、ガス調節の機能はありません。このインキュベーターは、電力供給がなくなると温度が急激に室温環境に戻ってしまいます。
いくつかのインキュベーターは外部の空気圧を必要としないデザインになっています。常に空気が供給されるインキュベーターの場合、扉を開くたびにコンプレッサーが注油をするため、建物の中央コントロールによる圧力はかえって邪魔になるでしょう。空気は単純な電気駆動式の水流ポンプで供給されています。空気と二酸化炭素を混ぜて供給する一般的な手法ではなく、3種類のガス(酸素、窒素、二酸化炭素)を混合して供給することもインキュベーターを調整もしくは購入することで、可能です。湿度は、チャンバーの底においた金属製トレイの抗菌剤を含む水を通して泡を立てるようにガス供給して維持をするようにしてください。湿度には勾配があるため、蒸発の早いシャーレは下の段に、フラスコは上の段に置くようにするというように、培地の蒸散の差異を調整すると良いでしょう。
22.5kgの標準的なサイズの二酸化炭素タンクが3つ壁に固定されるシステム(2つのタンクが電子配電箱に接続された)が二酸化炭素ガスの安定供給を効果的にするでしょう。この配電箱は市販されており、ガス圧が弱まると警報音が鳴るようになっています。この配電箱は、空のタンクから満タンのタンクに交換されると自動でスイッチが切り替わり、ガス供給もユニットの表面にあるトグルスイッチを使って手動で切り替えが可能です。他のタンクで二酸化炭素を供給する間、空になったタンクを補充してもらうことが可能です。
タンクは900lb(408kg)もの圧力を受けていますが、2段階の調節機能を持つスイッチボックスによりおよそ15lb(6.8kg)の圧力まで下げられます。一本のタンクから、2つのチャンバーそれぞれを備えたインキュベーター二台にガスを供給(計4つの培養器)することが出来、およそ2週間の間ガスを供給出来るでしょう。圧力計が空に近づいてくると900lb(408kg)が0になるまでにほぼ3~5日しかもたないでしょう。圧力がゼロになった場合には、スイッチボックスがガスを供給するタンクを自動的にバックアップのタンクに切り替えてくれるでしょう。この時点で3番目のタンクを空になったタンクと交換し補充のため発注をしてください。稀に、配電箱につながっているガスの配管にヒビが入っていたり、接続が甘くなっていることがあります。ガス漏れの音は聞こえる場合と聞こえない場合がありますが、このような場合には通常よりもガスの減りが早くなります。このような場合には、配電箱を分解して直す(最初にプラグを抜いてください!)ことが可能で、問題の配管を調整してつなぎ直すか取り替えるようにしてください。 |
|
Q
Incubators
A
The simplest reliable CO2 incubator is a water-jacketed chamber with removable shelves inside and control for gas flow, a pan in the bottom for water, a water jacket heater and thermostat with overheating protection. Both shelving and the frame that holds the shelves inside the incubator should be removable for sterilization, and a antimicrobial detergent should be added routinely to the water pan. More sophisticated incubators with considerable gadgetry can be purchased, including sensing and automatic control of gas and humidity levels, copper walls, chamber fans, and individual compartmentation inside the chamber. Eventually, a CO2-sensing and control device will pay for itself in gas savings, but this will take longer than might be expected, because a major fraction of the cost of CO2 is cylinder rental. Fans in incubators are useful when precise temperature control is required, as in work with temperature-sensitive mutants, because an undisturbed incubator chamber develops a humidity and temperature gradient from bottom to top. A disadvantage of a fan in the chamber is the potential for increased spread of microbial contamination throughout the incubator because of the increased air circulation. Copper incubator walls are argued to be antimicrobial, but are expensive. Incubators without water jackets, commonly used with roller bottle or spinner cultures, generally have fans but usually do not have gas flow control. These incubators rapidly return to ambient temperature if power is interrupted.
Some incubators are designed so that external pressured air is unnecessary. In incubators that require continuous air flow, pressurized air derived from a central building source may be undesirable because the compressor introduces oil into the system each time it engages. Air can be supplied by simple, electrically powered aquarium pumps. Incubators can be modified or purchased to use a three gas mixture (eg., oxygen, nitrogen, carbon dioxide) instead of the routine air-carbon dioxide mixture. Humidity is best maintained by bubbling the entering gas through the water pan at the bottom of the chamber. Because of the humidity gradient, it may be useful to routinely place cell culture plates on the bottom shelves and flasks on the top shelves to minimize evaporation from the plates.
An effective approach for carbon dioxide gas delivery is a system in which three 50 lb standard grade carbon dioxide tanks are secured to a wall, with two tanks connected to an electronic switch box. These boxes are commercially available and activate an audible alarm if they sense no gas pressure. The switch-box automatically switches from an empty tank to a full tank, and gas supply also can be switched from tank to tank manually using a toggle switch on the front of the unit. One of the connected tanks is a full back-up, while the other supplies carbon dioxide to the incubators.
Tanks are received with about 900 lbs pressure and are stepped down to about 15 lbs pressure at the switch-box with a two step regulator. A single tank can supply gas to two double incubators (four chambers) for approximately two weeks. When a tank approaches empty, the tank pressure gauge will fall from 900 to zero over 3 to 5 days. At zero pressure the electronic switch will automatically transfer supply from the now empty tank to the back-up tank.The third tank then replaces the empty one, and a new one is ordered. Occasionally, the gas line tubing used inside the electronic switches will become cracked, or unseated on its fittings. The escaping gas may or may not be audible, but the tank will empty much more rapidly than normal. These problems can be remedied by dismantling the box (unplug it first!), trimming or replacing the faulty tubing and reseating. |
|
|
Q
研究室の設計
A
研究室内に置かれる細胞培養用のクリーンベンチフードの設置場所は、フードの機能を妨げないように空気の流れによる影響が小さい場所を選び、また人から由来する微粒子によるコンタミネーションの影響を受けない場所に置くよう注意すべきでしょう。対策としては、細胞培養用の装置は人の出入りの少ないラボの小さな部屋へ移したり、細胞培養用の部屋が大きければ部屋の一角を細胞培養用の専用コーナーとして位置づけることで、このような環境を作ることが可能となるでしょう。ラミナ―フローフードのある小部屋では、フード自体から排出される滅菌された空気が部屋の滅菌性を維持してくれるでしょう。
細胞培養用のフードはその機能を弱めてしまう様な、研究所の建物自体からくる高速換気フードの影響を受けないところに置くようにしてください。インキュベーターや顕微鏡、遠心機は、培養物の物理的移動を最小限におさえるために出来るだけ細胞培養用フードから近い場所に置くようにするべきです。培養容器をフード内の作業スペースから顕微鏡へ移したり、インキュベーターへ移したり、というように、細胞培養の作業は考えられる限り最も効率の良い作業環境であるようにするべきで、作業の効率化により災害の回避にもなるでしょう。
細胞専用の小部屋で上記すべての要素が考慮されている場合、研究所の大きな部屋から細胞培養専用の小部屋にあるCO2インキュベーターへ直接ガス間を配管して供給することも検討の価値があるでしょう。これにより、小さな部屋での万が一のガス漏れを避けることが出来、シリンダーやレギュレーター、アラームなどが大勢の人の近くにあることで、不注意や非常事態のリスクを回避することにつながります。二酸化炭素自体は毒性を有するガスではありませんが、二酸化炭素は空気よりも比重が重いので、フロアの下に淀んでいます。部屋が密閉されガスが充満すると窒息の原因になり、また窒素ガスも同様です。もし研究室に入ってガス漏れの音が聞こえたり、ガスの管が壊れている疑いがある場合には、部屋を直ちに解放し、後ろのドアを開け放して処理する前に他の人を呼んでください。
いくつかの研究室では細胞培養室の入口に粘着マットが置かれ、入ってきた人の靴に付着する粉塵を吸着するようになっています。いくつかの研究室では、空気エアロックまたは前室を設けたり、陽圧や陰圧のバリアや部屋どうしを行き来するための通路を取り入れていますが、これらは危険性のある実験と考えられる場合にのみ深刻に考慮されるべきものです。
フリーザーや液体窒素タンク、陽圧や陰圧の部屋のセンサーとして警告音を使用することは有効です。100%排気用にデザインされたラミナ―フローフードでは、空気の流れや排気が不十分である場合にアラームが鳴り警告してくれるようになっています。
細胞培養用の研究室の電気供給が失われた場合、デフォルトに戻されるので注意が必要です。それは上記で説明のあったように、二酸化炭素ガスのレギュレーターボックスは電気制御されているので、電力が供給されなくなるとガスの流れが止まってしまいます。このような場合、インキュベーター内部の気流を循環させるため、電気ポンプで空気をインキュベーターへ送ることが理想的で、この様にすることである程度の間、インキュベーター内部のガス条件を維持することが出来ます。水流ジャケット式のインキュベーターでドアを開けられていない状態であれば、温度や環境は一時間ほどの間であれば維持できるでしょう。
ローラーボトルやスピナー容器用の水流ジャケット式でないインキュベーターの場合にはより注意が必要です。一定時間内であれば、温度を一定に保ち、ローラーボトルやスピナーボトルを回転させ続けられる非常時用蓄電システムがこのインキュベーター用に市販されています。pHが適切に保たれている状態であれば、非常時には、フラスコの口を閉めて室温に置いておくことで、ほとんどの細胞が生き残ることが出来るでしょう。
電力供給や、ガス供給システム、排気などが遮断されたことによる影響に関して、特別な配慮が必要とされるものには、陽圧、陰圧の研究室、100%排気のラミナ―フローフードのある研究室や危険物用の換気フードのある研究室などがあげられます。これらには、研究室への吸気と排気、危険物用の換気フードからの排気と細胞培養フードからの排気などが含まれます。 例えば、研究室の培養フードの操作が終了した際に、研究室にある排気フードが常に加わっていた力が遮断されたことにより緊急用電源に切り替わることにより危険性が生じます。これは、潜在的に危険性のある研究材料が細胞培養フードから吸引され部屋に引かれることがあるからです。
非常用電源により細胞培養用のラミナフローフードが運転され、排気フードが運転されていない状態、もしくは弱く運転されている場合において似たような状況が起こり得ます。更に、通常運転されているものが止められた場合に研究室へどのように供給と排気がなされるかによって、潜在的に危険性のある材料が研究室から建物の空気循環システムへ入り込む可能性もあります。これらの重大な問題点は、機器のデザインを決める際や導入の際やこれらの定期点検を行う時点において、エンジニアと組織の生物学的安全性担当者に相談するべきでしょう。 |
|
Q
Laboratory design
A
Attention should be given to placement of the cell culture hood in the laboratory to minimize air flow that may interfere with hood function and to minimize exposure to air- or personnel-borne contaminating particulates. This might best be accomplished by relegating cell culture equipment to small rooms that are not high traffic laboratory areas, or by designating a particular corner of a larger laboratory for cell culture purposes. In a small room with a standard laminar flow hood, the sterile exhaust from the hood itself will help maintain sterility in the room.
It is best to place the cell culture hood outside the influence of any high velocity laboratory fume hoods that might compromise cell culture hood function. Incubator, microscope and centrifuge should be a close as possible to the cell culture hood work-space to minimize physical movement of the cultures. Cell culture work even in the most efficient environment involves considerable transfer of vessels from hood to microscope to incubator, etc., and economy of movement helps prevent disasters.
If all of the above elements can be accommodated in a small, dedicated cell culture room, then it may be worthwhile to plumb a carbon dioxide gas line to the incubator from a larger laboratory room. This avoids the possibility of a potentially dangerous gas leak in a small room, and also makes the cylinders, regulators and alarms accessible to a larger number of people to prevent oversights and emergencies. Although CO2 itself is not a toxic gas, carbon dioxide is heavier than air and will sink to the floor. A room suddenly filled with the gas can cause asphyxiation, and the latter is also true for nitrogen. If you enter a laboratory and hear a rush of gas or have other suspicion that a gas line might be broken, the best course of action may be to vacate the room immediately, leaving all doors open behind you, and seek help before you proceed.
Often a sticky mat is placed at the entrance to a cell culture room to trap particulates on the shoes of entering personnel. Some laboratories incorporate airlock or anterooms, positive or negative pressure barriers or intercoms for communication between rooms, but these may be a serious consideration only if experiments of a hazardous nature are contemplated. Malfunction alarms are useful on freezers, liquid nitrogen tanks and positive or negative pressure rooms. Most laminar flow hoods, especially those designed for 100% exhaust, have alarms to indicate insufficient air flow or exhaust.
Thought should be given to the default situation if electrical power fails in a cell culture laboratory. For instance, using the carbon dioxide gas switch-boxes described above, gas flow will stop when power fails, because the regulator boxes are controlled electrically. In this case it is ideal also to use electrically pumped air to the incubators, so all air flow will also stop in the incubators. Under these conditions tolerable atmosphere and temperature will be maintained for hours in a water jacketed incubator if incubator the doors are not opened.
A roller bottle or spinner incubator without water jacket will require more attention. Battery-powered emergency systems are available for these incubators that can maintain the bottles turning, the spinners spinning and the temperature correct for a short period. In an emergency flasks containing cells can simply be screwed tightly shut and left a ambient temperature. Most mammalian cell types will survive at room temperature as long as proper pH is maintained.
Negative or positive pressure rooms or rooms with 100% exhaust laminar flow cell culture hoods and fume hoods for use with hazardous materials require special consideration with regard to power interruption and configuration of supply and exhaust air sources. This includes room supply and exhaust, fume hood exhaust and cell culture hood exhaust. For instance, a room in which the cell culture hood ceases to operate, but a fume hood in the room switches to emergency power when routine power is interrupted can present a hazard, because potentially hazardous material can be drawn out of the cell culture hood and into the room.
A similar situation may occur if the laminar flow cell culture hood continues to operate on emergency power but the fume hood does not operate, or operates at reduced air flow. Furthermore, under these circumstances potentially hazardous material could further escape the room and enter the building air supply, depending on how the room supply and exhaust is configured to respond when regular power is interrupted. These serious issues require consultation with engineers and institutional biosafety officers at the time of design and installation of the equipment and regular inspection thereafter.
|
|
|
Q
初代細胞の培養
A
小動物から組織を採取する際に麻酔を使用すると、培養すべき細胞に対して影響を与えてしまうので、二酸化炭素による仮死状態、または頚椎脱臼により安楽死させると良いでしょう。組織を採取する前には、外側の皮膚を70%エタノールで除菌してください。アルコールに浸漬させた動物で、特に長毛動物の場合には炎滅菌しないよう注意してください。組織は、組織培養用フードの中で滅菌用具(オートクレーブや70%エタノールに浸漬した)を使用して採取してください。通常の作業では、鋭利なはさみ数本と鉗子で十分でしょう。
組織は、フード下で培養用ディッシュに移し、余分なもの(脂肪や膜、他の組織や骨、凝固血液、寄生虫、毛)はそぎ落してから、適切な溶液(PBS ; Ca, Mg free)で洗浄してください。組織は、ハサミで裁断し、適切な分離溶液でインキュベートしてください。
簡易的な分離用の溶液には、PBS(Ca,Mg free)で希釈したトリプシン溶液(0.25% トリプシン+EDTA)があります。なお、PBSは重炭酸バッファー化されていないため、バッファーとして使用する場合にはCO2インキュベーターには入れないでください。各種の組織初代培養細胞は、コラゲナーゼ、ヒアルロニダーゼ、DNAseまたは他のプロテアーゼを必要とし、順序良く細胞分散させて下さい。死細胞から放出される染色体を分解するためにDNAseを使用したり、DNAに関連するたんぱく質を分解するためにタンパク分解活性を有するトリプシン溶液を使用し、DNAが水和されることで溶液の粘性が増加します。この様に、DNAseはタンパク質と分離したDNAを消化するので、いくつかのトリプシン溶液には、十分のDNAseが含まれる様に調整されたものもあります。凝集塊が分解される過程は顕微鏡で観察することが可能で、懸濁液を定期的にピペッティングし撹拌してください。
培養を終えるタイミングは、用いる細胞によりけりです。いくつかの細胞では、細胞がほぼ一つ一つばらばらになるまで培養するのが最適であったり、他の細胞では細胞がおおむね1ダース程度、から少し少ないくらいの塊を形成する状態になったら培養を終えなければなりません。一般的に培養の初期段階では、細胞が均一な同一の形質を有するよう調整するため1細胞に分散されたら、それ以上長くインキュベーションはしないで下さい。懸濁液から大きな組織塊を除くには、卓上遠心機で数秒間遠心することにより簡単に沈殿させて下さい。更に上清に残った細胞分散液を取り分け、さらに遠心して沈殿させることで細胞を回収することが可能です。回収した細胞は適切な培地に再懸濁し、細胞数をカウントしてから培養容器へ播種してください。分離された大きな細胞塊から同様の処理により、再び細胞懸濁液を回収することが可能です。
初代培養細胞は、調整の度に性質が異なるため、血球計算板でカウントしてから播種する方が良いでしょう。培養初期の浮遊状態の細胞は生存率が低いため、初代細胞の播種密度は、継代後の細胞密度よりも高くしておくべきでしょう。培養8~16時間後に播種後デブリス除去のため培地の交換を実施してください。摘出する組織やそれをどう調整したかにより、培養の初期段階で非接着性の赤血球が大量に混入することがあります。培養初期では様々な細胞が混在することがありますが、何回かの継代をすることで、均一な細胞になるでしょう。 |
|
Q
Initiation of primary cultures
A
Small animals from which tissue is to be obtained may be best killed by CO2 asphyxiation or cervical dislocation, because anesthesia may have effects on the cells to be cultured. The outside of the animal can be swabbed with 70% ethanol to sterilize before removing the tissues. Flaming is discouraged, particularily on alcohol-soaked, hairy animals.
Tissue is removed with sterile instruments (autoclaved or dipped in 70% ethanol) under a tissue culture hood with sterile instruments. For usual jobs several pair of sharp scissors and forceps are adequate.
Tissues are placed in a culture dish under a hood, trimmed of unwanted material (fat, membranes, other tissues, bone, blood clots, parasites, hair) and washed with a suitable solution (eg., phosphate buffered saline without calcium or magnesium). Tissues are minced with scissors and incubated with an appropriate disaggregation solution.
The simplest might be a trypsin solution (0.25% crude trypsin with 1 mM ethylenediamine-tetraacetate (EDTA) in phosphate buffered saline without calcium or magnesium). If PBS is used as the buffer, do not incubate the samples in a carbon dioxide incubator, because PBS is not bicarbonate buffered. Primary culture of some tissues may call for additional collagenase, hyaluronidase, DNAse, or other proteases, exposed to cells in a defined sequence. DNAse is sometimes used because dead cells will release chromatin, and the protease activity of the trypsin solution will destroy the DNA-associated proteins, leading to hydration of the freed DNA and a noticeable increase in viscosity of the suspension. DNAse will digest the released material. Some crude trypsin solutions may contain sufficient contaminating DNAse to prevent this problem. The progress of disaggregation can be monitored with a microscope and the suspension should be pipetted or agitated periodically.
The point at which the incubation is terminated depends on the cell type to be cultured. For some cell types, the appropriate point is reached when the major portion of the cells are single cells; for other cell types one should stop when the cells primarily exist as aggregates of a dozen or less cells. In general one should not extend the initial incubation for long periods in an attempt to obtain an entirely homogeneous single cell suspension, because lengthy incubations will lead to cell death. The larger chunks of tissue may be allowed to settle for a few seconds in a centrifuge tube, and the cell suspension removed and centrifuged in a bench top centrifuge. Cells are resuspended in the appropriate culture medium, counted and plated. Cells from the larger chunks that settled from the suspension may be further harvested by repeating the procedures described above.
Cells for primary culture are best counted with a hemocytometer prior to plating because of the heterogeneous nature of the preparation. Often the primary culture plating density should be higher than densities which should be used at later passage because the majority of cells in the initial suspension will not survive or grow in culture. Change medium 8 to 16 hours after plating to remove debris. A significant amount of nonadherent red blood cells may be present in the initial plating, depending on the nature of the tissue and how the tissue was prepared in the early steps.The cells in initial culture may represent multiple cell types, but the cultures become more homogeneous upon multiple passage. |
|
|
Q
多継代培養とクローニング
A
浮遊細胞の継代は、細胞密度が低くなるように培地を加えて希釈することが可能です。また、浮遊細胞を培地ごと遠心し、上清を捨て新しい大容量の培地に再懸濁して希釈することも可能です。通常の接着細胞の継代では、培養上清を除いたのちにトリプシンEDTA溶液を加えフラスコからはがれるまでインキュベーションしてください。初代培養細胞のほとんどは一様な速度ではがれないかもしれませんし、全くはがれてこないこともあります。通常のトリプシン処理を何回か繰り返し行うと、接着の弱い細胞が選択されて回収されるので、はがれやすい細胞の割合は増すでしょう。トリプシンEDTAと等量の血清を含む培地を加え、遠心回収後、新しい培地に懸濁して播き直してください。
2~3回の継代により、細胞は血球計算板でカウントできるまでに十分均一な状態になるでしょう。細胞数のカウントが自動化できる市販の機種として特許や市場の考察ににより指示されているのは、「コールターカウンター」という機種ですが、定期保守点検が必要で、トラブルが頻発するために、大変面倒ではあります。細胞カウントに使用するリン酸バッファーは使用前にフィルター濾過しなければなりません。これは、厳密な滅菌が必要なのではなく、細胞数を計測する際に阻害要因となる微粒子を除くために必要とされる作業です。もし、バックグラウンドが50~60を超える値となったら、システムをフラッシュし、溶液の容器やディスペンザープローブなどにデブリスが付着していないかどうかチェックして下さい。細胞数が10,000個以上の場合には調整が必要で、1,000-35,000細胞/0.5mlの範囲内で維持する様にしてください。
電極は、常に適切な溶液で、電化を保つようにしてください。ポンプは週単位で油を注入し、ガラス製の栓には毎月グリースを塗ってください。水銀カラムが割れた場合、水銀自体を取りかえるか、水銀とガラス容器を掃除するべきでしょう。新しい水銀を使う場合には酸性クリーニング方が良いでしょう。
初代細胞や継代の浅い初期の接着細胞には、限界希釈法より、クローニングリングを使用する方が良いでしょう。継代の浅い初期の接着細胞では、一般的に低密度での培養は適していません。クローニングリングを外したら、密度が高くなるように小さいウェルプレート(24well プレート)に播種する方が良いでしょう。浮遊細胞では、もし低密度での生育が難しいのであれば、限界希釈法でコンディション培地を使用してクローンを作成すると良いでしょう。
|
|
Q
Multipassage culture and cloning
A
Passaging of suspension cultures may be accomplished simply by dilution, or by centrifugation of cells out of the old culture medium and resuspension into a larger volume of fresh medium. For routine passaging of adherent cells, the medium is removed, trypsin/EDTA solution is added and the cells incubated until detached. All cells of primary culture may not detach at the same rate, and some may not detach at all. The percentage of cells that will detach upon routine trypsinization increases upon multiple passage because of the selection for less strongly attached cells. A volume of serum-containing medium equal to the volume of trypsin/EDTA solution is added and the cells are centrifuged, resuspended and replated in fresh medium.
Often by the second or third passage, the culture may be sufficiently homogeneous to allow counting by cell counter designed for such purposes. Patent and market considerations dictate that the mostly likely automated cell counter available will be a Coulter Counter. These are sufficiently complicated to require routine maintenance and occasional trouble shooting. Phosphate buffered solutions used for counting cells require filtration before use. These should be free of particulates that may interfere with counting, but need not be strictly sterile. If the background count is greater than 50-60, flush the system and check for debris in the reservoir, dispenser, probe, etc. Cell counts should be maintained between 1,000 to 35,000 per 0.5 ml counted, with corrections applied when counts exceed 10,000.
Always keep the electrode in an appropriate solution. The pump should be oiled weekly and glass stopcocks greased monthly. Splitting of the mercury column indicates that the mercury should be changed or the mercury and glassware cleaned. Using new mercury may be preferable to acid cleaning.
Cloning of primary or early passage adherent cells is best accomplished with cloning rings, rather than by the limiting dilution method. Early passage cells generally do not tolerate culture at low cell densities well. After removal with cloning rings, the cells may be placed in small wells (eg., 24-well plates) in order to maximize cell density. Suspension cultures may be cloned by limiting dilution, using conditioned medium if survival at low cell density is a problem. |
|
|
Q
凍結保存細胞
A
細胞の起眠率を最大限にするためには、一般的には、凍結の際に徐々に温度を下げること、融解時には素早く溶かすことが重要です。細胞は、10%の血清と10%DMSOを含む培地で凍結しますが、溶解時の生存率は細胞によりまちまちです。ある細胞種では、90%の子牛血清(Calf Serum)もしくは胎児牛血清(fetal calf serum)に、10%DMSOを加えた培地で凍結したら、良い起眠率が得られています。これら溶液は、フィルター滅菌後に-20℃が可能です。凍結する場合、細胞はトリプシン処理後、遠心回収し、凍結保存用培地で5 x 10(5) to 2 x 10(6) cells/mlの濃度となるように再懸濁し、凍結バイアルに1mlづつ分注して保存してください。
凍結するための冷却装置には 温度コントロール制御が可能な装置もありますが、簡単な方法としては、まずは4℃で30分間静置し、発砲スチロール断熱された容器へ移してから-86oCの低温フリーザーで一晩静置し、それから液体窒素へ入れる方法もあります。4℃と-86oC低温フリーザーの間に、数時間-20oCもしくは-60℃などのより低温のフリーザーで静置していただくことも可能ですが、必須ではありません。
細胞を溶解する際には、まずゴーグルを装着してからバイアルを液体窒素タンクから出し、37oCのウォーターバスで素早く氷がなくなるまで温めてください。液体窒素がバイアルの内部に入りこんでいる場合、溶解時にバイアル内部に閉じ込められた液体窒素が温まることで急激に膨張し、爆音とともに突然破裂することがあるので注意してください。フラスコに溶解液を移し、細胞が接着したらすぐに培地交換を実施してDMSOを除いてください。もしくは、バイアルの中身を培地を加えて遠心し、新しい培地で細胞のペレットを懸濁してからフラスコへ播種するようにしてください。
初代細胞を長期保存するためには、初期の段階で分散した細胞浮遊液を10%DMSOと10%血清を含む培地に入れ、上記の手順と同様に液体窒素で凍結保存してください。大きな細胞塊であっても他のシングルセルと同じように均一に凍結し溶解することもあり生育する可能性が十分にあるため、溶解後すぐに細胞を選別するべきではありません。
|
|
Q
Freezing cells
A
Cells are usually frozen slowly and thawed quickly for maximal survival. Cells may be frozen in 10%-serum-containing 10% dimethyl sulfoxide DMSO, and viability upon thawing may vary, depending on the cell type. Greater success with some cell types can be achieved in a freezing medium of 90% calf or fetal calf serum and 10% DMSO. After filter sterilization, these solutions may be stored at -20oC. For freezing, cells are trypsinized, centrifuged, resuspended at a concentration of 5 x 10(5) to 2 x 10(6) cells/ml in the freezing medium and 1 ml aliquoted into each freezing vial.
Although devices are available for precisely controlled freezing of cells, a simple way is the following: refrigerate (4oC) for 30 minutes; transfer to a styrofoam-insulated container and place in a low temperature freezer at -86oC overnight, then transfer into liquid nitrogen. A -20oC incubation of a few hours may also be inserted between the refrigerator and low temperature freezer, but may not be essential.
To thaw cells, wearing goggles, remove the vial from the liquid nitrogen and warm the cells in a 37oC water bath as quickly as possible until ice is completely gone. Be careful; thawing a vial that explodes because of rapid expansion of nitrogen trapped inside can be a deafening, blinding or otherwise dangerous experience for you and others that may be around. Transfer the contents to a flask or plate and change medium in the flask as soon as cells have settled and stuck to the flask to remove the DMSO. Alternatively, one may centrifuge the vial contents diluted with culture medium, resuspend the pellet in fresh medium and transfer to a flask or plate.
For the long-term storage of primary material, cell suspensions derived from the initial disaggregation may be frozen in liquid nitrogen in medium with 10% dimethylsulfoxide and serum, as described above. However, the cells must be reasonably desegregated for good viability upon thawing, since large clumps of cells do not freeze or thaw evenly, leading to cell death. |
|
|
Q
論文
|
|
Q
References
|
|
A
Barnes, D., Sirbasku, D. and Sato, G., editors., Cell Culture Methods For Molecular and Cell Biology, 4 Volumes, Wiley-Liss, 1984.
Barnes, D. and Sirbasku, D. editors, Methods In Enzymology; Peptide Growth Factors, Volume 146, Part A, 452 pages, and Volume 147, Part B, 487 pages, Academic Press, Inc., N.Y, l987.
Barnes, D., Mather, J. and Sato, G. editors, Methods In Enzymology; Peptide Growth Factors, Volume 198, Part C, 580 pages, Academic Press, Inc., N.Y, 1991.
Butler, M. J., Animal Cell Culture and Technology, IRL Press, 1997.
Darling D. C. and Morgan S. J., Animal Cells: Culture and Media, 151 pages, John Wiley and Sons, 1994.
Darling, D. C. and Morgan, S. J., Animal Cell Culture: Introduction to Biotechniques, Bios Scientific Pubublishers Ltd, 1994.
Doyle, D., Hay, R. and Kirsop, B. E., editors, Animal Cells: Living Resources for Biotechnology, Cambridge University Press, 1991.
Freshney, R. I., Editor, Animal Cell Culture: A Practical Approach, 329 pages, IRL Press, 1992.
Freshney, R. I., Culture of Animal Cells: A Manual of Basic Techniques, 3rd Edition, 486 pages, Wiley-Liss, 1994.
Harrison, M. A. amd Rae, I. F., General Techniques of Cell Culture (Handbooks in Practical Animal Cell Biology), Cambridge University Press, 1997.
Jakoby, W. B., and Pastan, I. H., Methods In Enzymology; Cell Culture, Volume 58, 642 pages, Academic Press., Inc., 1979.
Murakami, H., Yamane, I., Hayashi, I., Mather, J., Barnes, D, and Sato, G. eds., Growth and Differentiation of Cells in Defined Environments; 484 pages, Springer-Verlag, Inc., 1985.
Pollard, J. W. and Walker, J. M., Animal Cell Culture. Methods in Molecular Biology, Vol. 5, Humana Press, 1990.
Various editors, Proceedings of the Annual Meeting of the Japanese Association for Animal Cell Technology, Kluwer Academic Publishers, 1989-current.
Wasley, J. D., and May, J. W., Animal Cell Culture Methods, Lippincott-Raven Publishers, 1971. |
マウス、及びヒトのES細胞について
|
|
Q
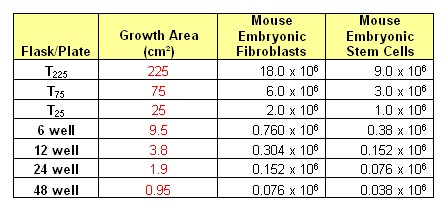
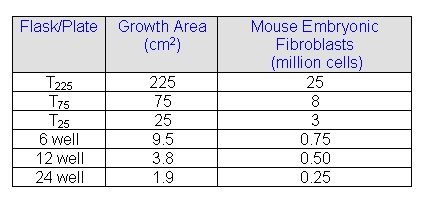
マウスESCを培養する際の最適な播種密度はどの程度でしょうか?
A
マウスESCに関する一般的な播種密度は下記のとおりです。 |
|
Q
What is the range of plating densities for mouse ESC?
A
Typical plating densities for mouse ESC are provided as following |
|
|
|
Q
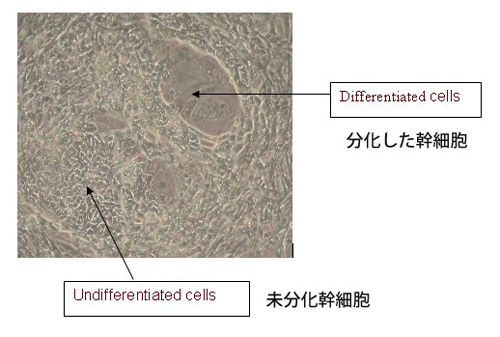
未分化のマウスESCと、分化したマウスESCは、どのような違いがあるのでしょうか?
A
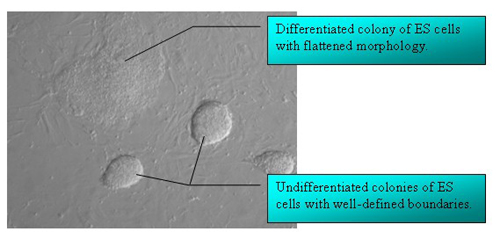
ES細胞の形態が突然分化する様な原因は必ずしも一つではなく、フィーダー細胞の質が悪かったり、密度が適切でなかったり、LIF濃度が低かったり、期限切れの培地を使用していたり、などの要因に依存して分化が誘発されます。
未分化なES細胞のコロニーはその輪郭が黒くはっきりと確認出来コロニーの周辺を未分化なES細胞の形態とは明らかに異なる平らな細胞(下記Figureを参照)囲んでいるのがわかります。 |
|
Q
How can I distinguish between differentiated and undifferentiated mouse ESC?
A
The morphologies of spontaneously differentiated ES cells are not necessarily identical and can be dependent on the cause of differentiation: poor feeder quality, inappropriate feeder density and/or low LIF concentration, use of expired media, etc.
Colonies are surrounded by flattened cells (see Figure) that differ morphologically from the undifferentiated ES cells in the centre, often the ES cells at the colony's edge appear dark and spiky. |
|
中心部が壊死してしまっている大きなコロニーですが、境界線がしっかりしているESCが数日間継代されなかった場合にこのような形態に変化するようなことが起こり得ます。
集団としてではなく個々の細胞として存在するコロニーでは、分化したES細胞の核が明瞭に確認できるようになっています。
単層の細胞様の平らなコロニーは、円のような境界線に囲まれています。 |
|
-Large colonies with necrotic centers, the ESC appear as cells with defined boundaries: happens to cells which were not passaged for several days.
Colonies appear as individual cells rather than as cynical mass, often the cell nucleus is clearly visible in differentiated ES cells.
Flattened colonies that appear as single-cell layers surrounded by a circle-like boundary. |
|
|
Q
マウスESCの継代はいつ頃が最適ですか?
A
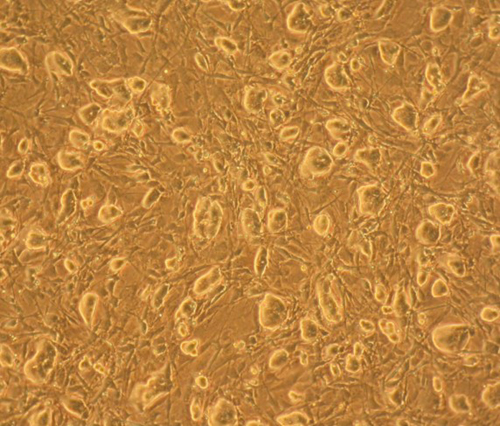
マウスES細胞はコンフルエントに達する前に継代して下さい。もし個々の細胞が接触し始めたり、あまりに大きな細胞塊にまで増殖した場合、細胞は分化してしまいます。
マウスES細胞は、常に1-2日に一度は継代するようにしてください。
継代比率は、細胞数に依存して決まり、使用されるフラスコに適した播種密度で培養するようにしてください。継代比率が1:7以上にならないように注意してください。
平均的には、細胞密度やコロニーの大きさが下記の画像と同様、もしくはそれ以上である場合には、継代したほうが良いでしょう。 |
|
Q
When should mouse ESC be passaged?
A
Mouse ES cells should be passaged before they reach confluency. The cells will differentiate if they come into contact with each other or are allowed to grow too large.
Routinely, mouse ES cells should be passaged every 1-2 days.
The split ratio is determined based on the cell count and the correct plating densities for the culture flasks used. Do not use a split ratio greater than 1:7.
On average, it is good to passage if you see that the density and size of the colonies is equal to or greater then the colonies in the following picture. |
|
|
|
Q
ES細胞を融解する際、特に注意するべき点は何ですか?
A
DMSO溶媒は高温において細胞に対する毒性を示すことから、溶解後にすぐ取り除かない場合には致命的なダメージを与えかねません。一般的な細胞培養の手順書に記載があるとおり、すべての準備を整えてからバイアルを溶解することは非常に重要です。凍結バイアルは素早く溶解し、再凍結は避けてください。ほとんど溶解したことが確認されたら、バイアルから細胞を吸い上げて、37℃で温めておいた培地に加えてください。温めておいた余分な培地を使用して空のバイアルをリンスするのは、再構成された細胞の懸濁液中に存在するDMSO濃度を薄めるだけでなく、バイアルの底に残っている細胞を全て回収するために行います。もしくは、細胞内に入り込んだDMSOが細胞外へ排除されるための時間を与えるために30分以上の時間をかけて段階希釈を行うことで、急激な希釈による細胞の浸透圧ストレスを緩和することも可能になります。 |
|
Q
Is there any special attention that must be paid when thawing ES cells?
A
Dimethyl sulfoxide solvent is toxic to cells at higher temperatures and may prove fatal if not removed post thaw. As described in the general procedures of the cell line, all preparations should be complete before a vial is to be thawed. Frozen vials should be thawed quickly to avoid recrystallization. Cells should be removed from the vial and placed in warm media (37oC) when it is observed that the thaw is nearly complete. The vial should then be rinsed with additional amounts of warm media to collect residual cells as well as to dilute the DMSO concentration in the reconstituted suspension. Alternatively, a stepwise dilution may be performed over 30 minutes to reduce osmotic stresses placed on the cells during a more rapid dilution as well as to give intracellular DMSO time to diffuse into extracellular space. |
|
|
Q
ヒトES細胞は、マウスES細胞と比べ、生育に違いはありますか?
A
ヒト由来のES細胞は、マウスのES細胞と比べるとかなり生育が遅いでしょう。マウスのES細胞のコロニーが播種後その日のうちに確認が出来るのに対し、ヒトES細胞のコロニーがようやく確認ができる程度までになるには更にもう一日かかり、また完全に樹立されたヒトES細胞コロニーとして分割できるようになるまでには、平均で最高5日~6日かかるでしょう。ヒトES細胞を播種後48時間までは培地交換を行いませんが、その後24時間ごとに培地交換を実施してください。 |
|
Q
Do hES cells grow at a different rate than mouse ES cells?
A
Human ES cells grow significantly slower than mouse ES cells. Where mouse ES cell colonies are visible the day after plating, it may take an hES cell colony another day to become readily noticeable and can take on average up to five or six days before a fully established hES cell colony is ready to split. Media changes are not performed during the first 48 hours on hES cell cultures, but are performed every 24 hours thereafter. |
|
|
Q
ヒトESCを培養する際の最適な播種密度はどの程度でしょうか?
A
ヒトESCを培養するための、推奨されるフィーダー細胞(MEF)の培養密度について |
|
Q
What is the range of plating densities for hESC?
A
Recommended feeder cells (MEF) density for culturing hES |
|
これは、ヒトES細胞を培養するために使用されるMEFの一般的な播種密度です。いくつかの細胞株では他の細胞に比べ生育がより難しいものもあります。この場合には更に多くのMEFフィーダー細胞を必要とすることもあります。ご購入された各細胞に添付されているプロダクトインフォメーションシートに従い、培養するようにしてください。ヒトES細胞のコロニーは、溶解や継代の際、凍結の際には凝集塊のまま分散させずにしておくことで回復率が良くなるでしょう。 |
|
This is general recommendation of MEF plating density for culturing hES cells. Some lines are more difficult to grow than others. They may require more MEF feeder cells. Refer to production information sheet for the specific cell line you purchased. hES cell colonies are recommended to be kept in aggregates during thawing, passaging and freezing to ensure the best recovery. |
|
|
Q
マウスフィーダー細胞上で培養した未分化ヒトES細胞と分化したヒトES細胞は、どのように違うのでしょうか?
A
ヒトES細胞の形態が突然分化する原因は必ずしも一つではなく、フィーダー細胞の質が悪かったり、密度が適切でなかったり、期限切れの培地を使用していたり、などの要因に依存して分化が誘発されます。
中心部の未分化ESセルの周辺境界のあたりに平らな細胞形態が現れていますが、これは分化がすすんでいる特徴であり、またこれに伴って中心部にある未分化なコロニーの周囲で見られている光輪が消えていきます。また、未分化幹細胞の正常な形態から逸脱した分化した細胞は、位相差レンズを通して見ると、より大きく暗く見えるでしょう。
|
|
Q
How will I be able to distinguish between differentiated and undifferentiated hES cells when grown on mouse feeder cells?
A
The morphologies of spontaneously differentiated hES cells are not necessarily identical and can be dependent on the cause of differentiation: poor feeder quality, inappropriate feeder density, use of expired media, etc.
The appearance of flattened cells is characteristic of a colony undergoing differentiation is around its border surrounding undifferentiated ES cells at its center. This is often accompanied with the disappearance of the defined halo seen around undifferentiated colonies. In addition, differentiated cells deviate from the normal morphology of undifferentiated stem cells and often appear larger and darker when observed through a phase objective. |
|
|
|
Q
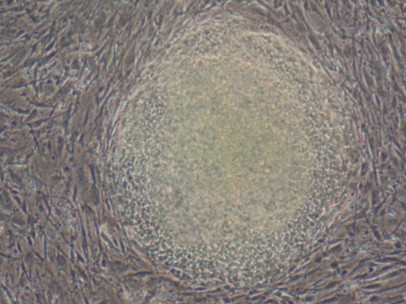
ヒトESCの継代はいつ頃が最適ですか?
A
ES細胞コロニーがオーバーグロースとならないように注意してください。セミコンフルエントな状態で分割することにより剥離が困難であったり、分化もしくは死に向かう可能性のある大きなコロニーが形成されるのを減らすことが出来ます。
分割のための日程やその比率を決めるため、ヒトES細胞の増殖速度やコロニーサイズ、細胞形態を十分注意して観察してください。平均的なヒトES細胞であれば、分割後5日から6日目あたりで更なる継代が可能になります。
分割できる状態になったヒトES細胞のコロニー形態やサイズに関する特徴が下記写真で掲載されています。 |
|
Q
When should hESC be passaged?
A
Care should be taken not to allow ES cell colonies to overgrow. Splitting when semi-confluent will help reduce the formation of large colonies which are more resistant to dissociation and more likely to undergo differentiation or cell death.
Close attention should be paid to growth rate, colony size, and morphology when monitoring human ES cell colonies in order to determine an optimal split date and ratio. On average, human ES cells should be passaged on the fifth or sixth day following the previous split.
The picture shown below exemplifies the morphology and size characteristic of a human ES cell colony ready to split. |
|
|
|
Q
凍結処理がマウスおよびヒトESCに対して与える影響はどの程度ですか?
A
ヒトES細胞は、マウスES細胞に比べ、凍結過程における影響に対して非常に敏感です。溶解後のヒトESCのの生存率は、かなり低いでしょう。しかしながら、生き残った細胞からは、1週間以内に目視で確認出来る程度のコロニーが現われてくるでしょう。ヒトES細胞はシングルセルとしては生き残ることができず、凍結や継代の際には小さな凝集塊として取り扱わねばなりません。しかしながら、すべての細胞は凍結過程においてダメージをうけるでしょう。凍結融解時に細胞膜内側に形成される氷の結晶によって細胞膜構造がダメージを受けます。凍結防止剤が凍結保存用培地に加えられることで、氷点を下げ、細胞中の水分を逃し、もしくは細胞膜を通じて細胞内のイオンや成分を溶液中へ運搬することで細胞内ので氷の結晶が形成されるのを防ぎます。ATCCで使用している凍結保存培地には、10%(1.4M)容量のDMSOが添加されています。急激に凍結をすると、細胞から水が放出される時間が十分にとれないために、一般的には望ましくない手法です。ゆっくり凍結することで、凍る前に細胞外の培地が細胞内へ入り込むことが出来るので最適な方法であると言えます。最適な凍結保存剤の濃度や、冷却率は細胞によって様々です。 |
|
Q
What effect does freezing have on Mouse and Human ESC?
A
Human ES cells are more sensitive to the freezing process than Mouse ES cells. The viability of hESC after thaw can be very low. However, visible colonies from those cells that do survive should appear within a week. Human ES cells also do not survive well as single cells and must be frozen or passaged as small clumps. However, all cells can be negatively affected by the freezing process. Cell structures are damaged during the freezing and thawing processes due mainly to the formation of ice crystals within the cell membrane. A cryoprotectant is usually added to cryopreservation media to lower the freezing point, dehydrate cells, or to carry intracellular ions and compounds through the cell membrane in solution in order to reduce the potential for ice formation within a cell. The cryopreservation media we currently use contains 10% (1.4 M) dimethyl sulfoxide by volume. A rapid rate of freezing is generally not desired as it does not allow ample time for water to be expelled from a cell. A slower rate of freezing is preferable as it allows media in extracellular space to freeze before media in intracellular space. The optimal cryoprotectant concentration and rate of freezing may vary for each cell line. |
|
|
Q
ヒトおよびマウスES細胞を培養する際に、必ずLIFを使用しなければなりませんか?
A
LIF(白血病抑制因子)はマウスES細胞を培養する際に分化を抑制するために使用される添加物です。フィーダー細胞が使用されていても添加します。しかしながら、LIFがヒトES細胞に対して有効であるかは不明です。LIFをヒトESC培養用培地に加えている研究室もいくつかありますが、そうしていない研究室もあります。まずは、それぞれの細胞専用に提供されている培養手順に従って培養するのが一番最適な手法と言えます。 |
|
Q
Must LIF be used for both human and mouse ES culture?
A
LIF (leukemia inhibitory factor) is used in Mouse ES culture to prevent cell differentiation. It is added even in the presence of a feeder layer. However, it is unclear whether LIF is in any way beneficial for Human ES culture. Some laboratories add LIF to their Human ESC Medium and others do not. It is best to follow the culture protocols provided for each specific cell line. |
|
|

 創薬支援サービスはこちら細胞・ヒト組織商材についてはこちらのページで紹介しております。
創薬支援サービスはこちら細胞・ヒト組織商材についてはこちらのページで紹介しております。