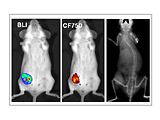
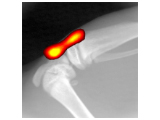
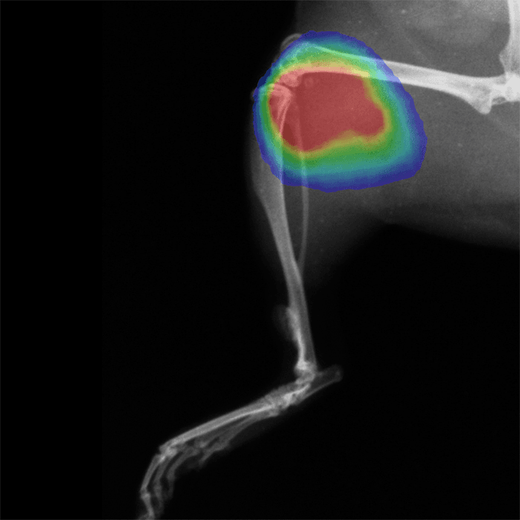
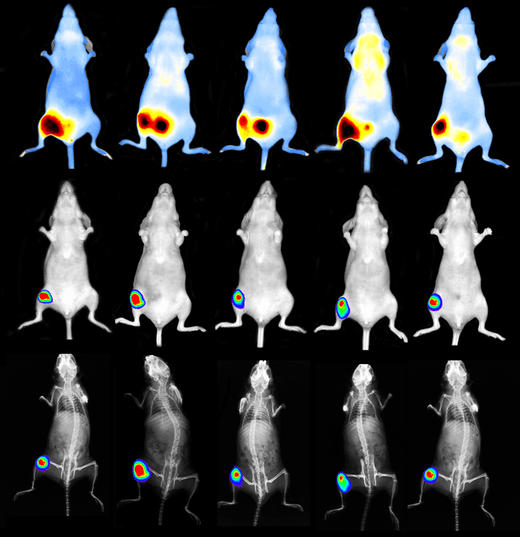
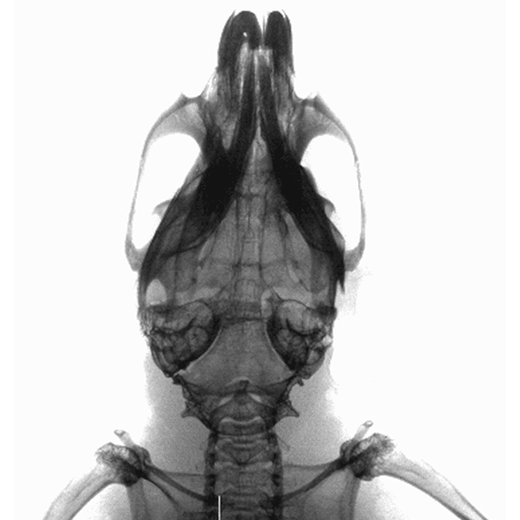
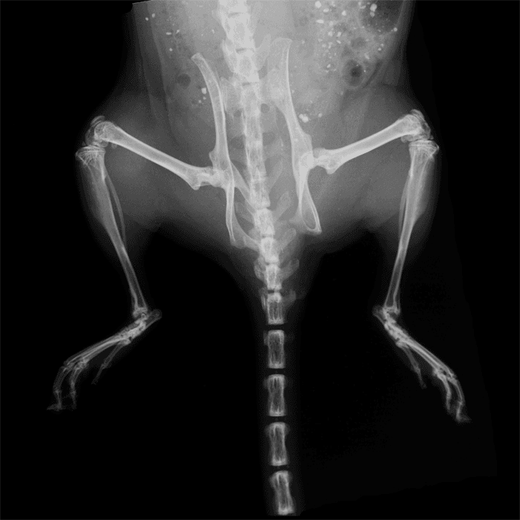
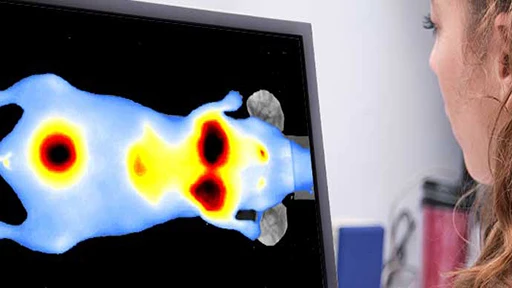
抜群の高感度と使い勝手の良さを誇る生体発光・蛍光イメージングにおける業界標準システム。
発光・蛍光に加えて、X線、CT、マルチモダリティ機能を備えた複合機まで豊富なラインナップから最適な機種を選択可能です。
メーカー純正の発光・蛍光試薬や発光細胞・細菌などのツールも豊富に取り揃えるほか、業界唯一となるユーザー会を毎年開催しており、インビボイメージングをトータルでサポートします。


IVIS Imaging Systemで
単一細胞レベルの高感度イメージングを実現
疾患の分子メカニズムの解明、疾患進行の追跡、新規治療薬候補の有効性評価などに関する最先端の研究には高感度かつ信頼性の高い光学イメージングデータが不可欠です。
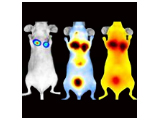
発光(BLI)と蛍光(FLI)イメージングは、それぞれ異なる特性を持ち、小動物イメージングにおいて強力なツールとなります。
- 発光(BLI)は、ルシフェラーゼ遺伝子を利用します。動物組織からのバックグラウンドシグナルが最小限であるため、高い特異性と定量精度を得ることができます。これにより、組織深部における腫瘍増殖などの生物学的イベントの検出やモニタリングを高感度に行うことができます。
- 蛍光(FLI)は、生体内の標的細胞の動態を可視化・定量化するのに適しており、細胞挙動の追跡等に優れた手法です。
IVIS Imaging Systemと、メーカー純正のIVISbrite & IVISsenseイメージング試薬により、研究者の方々の様々な研究目標の達成をサポートします。2D発光・蛍光イメージングから3Dトモグラフィー、X線CTとのマルチイメージングまで、研究に必要となる最適なツールを提供します。
In vivo光イメージングは、疾患の分子・生物学的プロセスを非侵襲的に研究するための迅速・低コストで使いやすく、かつ強力な技術です。また、発光および蛍光レポーターを活用することで、新規治療薬候補の探索や開発を加速することができます。
当社は2003年より、IVIS Imaging Systemの国内総代理店として販売を行い、これまでに全国各地のユーザー様へ累計320台※1を納品してまいりました。
また、2006年からは当社主催の「IVISユーザー会」を毎年開催しており、2024年10月には第17回目※2を迎えました。本ユーザー会には、多くのIVISユーザー様にご参加いただき、貴重な情報交換の場としてご活用いただいております。
ユーザー会では、ユーザー様による貴重な講演に加え、学生を中心としたポスター発表などの企画も実施。毎年、多くのリピーターの皆様にもご参加いただいております。アットホームでフレンドリーな雰囲気の会ですので、ぜひお気軽にご参加ください。
※1 2024年12月末までの累計
※2 2023年より「In vivo イメージングフォーラム」として開催。2020年、21年はコロナ禍により未開催。

Revvityは毎年、イメージングシンポジウムを開催し、イメージング製品をご利用いただいているお客様への感謝と、その研究成果の発表を行っています。本シンポジウムの内容は、ウェビナーにて聴講可能です。弊社イベントページからぜひご確認ください。
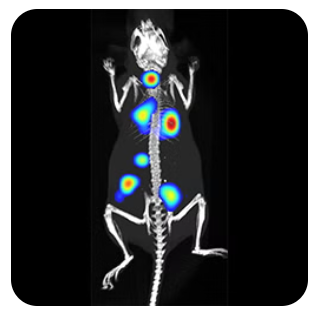
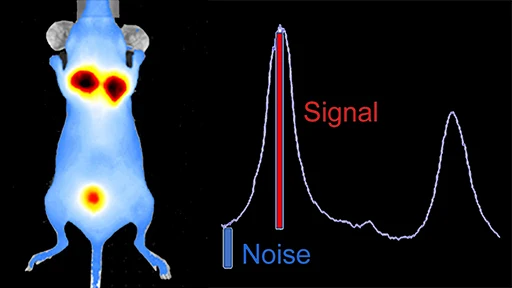
卓越した感度、コスト効率、使いやすさ。優れたシグナル対ノイズ比、高感度、短時間でのデータ取得、そして簡便な操作性を兼ね備えた発光イメージングは、疾患の生物学的メカニズムを非侵襲的に解明するための最適なツールです。
業界で最も多くの論文に掲載されているIVIS Imging Systemを活用し、In vivoイメージング研究の加速や創薬プロセスの推進を実現しましょう。
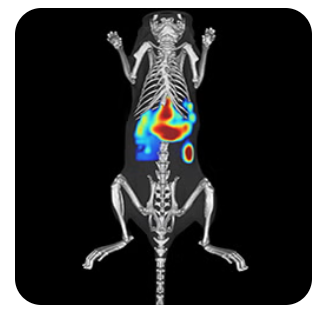
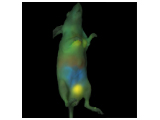
動物モデルからより多くの情報を取得。蛍光イメージングは、生体内の標的分子、シグナル伝達経路、および生物学的プロセスを可視化・定量化できる強力なツールです。
In vivo蛍光イメージングでは、特定の波長で励起されると光を放出する蛍光レポーター(蛍光タンパク質、蛍光色素、ナノ粒子など)を利用します。これにより、細胞や遺伝子の活性モニタリング、遺伝子発現の追跡、疾患の進行評価、新規治療薬候補の効果検証など、さまざまな生物学的研究に対応できます。Revvityは、研究ニーズに応じた多様な蛍光イメージング試薬を開発し、皆様の研究をサポートしています。

ターゲットからより多くの情報を取得し、研究の洞察を深めるために、幅広いイメージング試薬をご用意しています。これらのイメージング試薬は、アプリケーションに合わせて設計されており、IVIS Imaging Systemの全機種で最適に機能します。
- IVISense 蛍光プローブ、標識キット、蛍光色素、パネル
- IVISbrite 発光基質
- IVISbrite ルシフェラーゼ標識がん細胞株・細菌
Revvityの最先端試薬で、In vivoイメージング研究の可能性をさらに広げましょう。
特長
![]()
高感度
高感度画像を実現する特許取得済eXcelonコーティング専用CCDカメラ

高速イメージング
高速データ取得によりリアルタイムに画像を素早くデータ化

ハイスループット
標準で最大5匹のマウスの麻酔下測定が可能。オプションにより最大10匹まで対応

透過照明
サンプル下部から励起光を照射することで、深部の蛍光源を定量的かつ高感度に測定可能

落射照明
サンプル上部から励起光を照射することで、ハイスループットな蛍光測定が可能

画像融合
CT、MRI、超音波、PET、SPECTなど他のモダリティと光学データをシームレスに重ね合わせ可能

スペクトルアンミキシング
自己蛍光を除去し、複数の蛍光を簡単に識別、分離、定量化

解析ソフトウェア
In vivo光イメージングで、世界で一番使われている使いやすく直感的なLiving Image Software付属
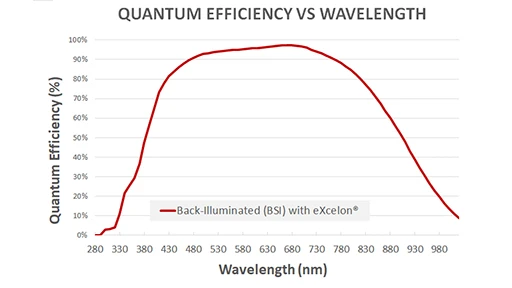
High-performance CCD camera
カメラとコーティングにより、可視および近赤外(NIR)スペクトル全域で、
より広い波長範囲で高効率にシグナルを検出可能。
- 発光/蛍光シグナルのシグナル対ノイズ比の向上
- より広範なNIR蛍光プローブに対応する波長域の拡大
カメラの主な特長
- 特許取得済み eXcelon®コーティング
- 裏面照射型、熱電冷却(-90°C)CCD
- 高い量子効率(ピーク効率 >95%)
- Imaging pixel:2048x2048(pixel size:13.5μm)
- 低リードノイズ
※機種により特長は異なります。詳細は、お問合せください。
ソフトウェア

Bring your in vivo images to life with Living Image software
業界標準の使いやすさと柔軟性に優れた標準搭載画像解析ソフトウェア
- 2D/3Dデータ解析用の包括的なツールセット
- ワンクリックで3D再構成
- スペクトラルアンミキシング(蛍光の複数同時検出・分離・自家蛍光の除去)
- その他イメージング装置との画像融合(CT、MRI、PET、SPECTなど)
- 画像取得を容易にする自動設定ツール
- バッチ処理分析ツール
- アニメーションや論文向けの図作成
- 複数ライセンスの同時使用可能
- ライセンスフリー NEW!
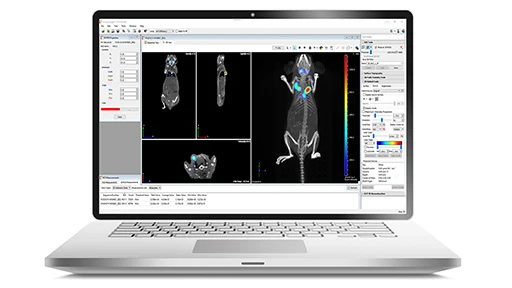
仕様
IVIS Imaging Systemには、卓上タイプのLuminaシリーズと、フロア自立タイプのSpectrum2シリーズの2種類、合計7機種があります。
Luminaシリーズには、エントリーモデルながら高感度な2D発光測定が可能なLuminaLT、LTの蛍光測定を強化したLuminaIII。IIIにX線機能が加わったLumina XRMS。およびハイスループットに5匹のマウス測定が可能なS5と、S5にX線機能が加わったX5があります。
Spectrum 2シリーズは、2D/3D超高感度発光·蛍光測定が可能で、CTなど他のイメージングデータとの融合(マルチモダリティ)も専用ソフトウェアで簡単にできます。SpectrumCT 2は1台で、発光・蛍光に加えて3DマイクロX線CT測定とマルチモダリティも可能です。
| 卓上タイプ IVIS Lumina シリーズ | ||||
|---|---|---|---|---|
IVIS Lumina LT

|
IVIS Lumina III

|
IVIS Lumina XRMS

|
IVIS Lumina S5

|
IVIS Lumina X5

|
| フロアタイプ IVIS Spectrumシリーズ | |
|---|---|
IVIS Spectrum2

|
IVIS SpectrumCT 2

|
機種

In vivo 発光·蛍光イメージングのエントリーモデル
- ペルチェ式-90℃冷却CCDカメラ搭載
- 発光と蛍光がどちらも高感度に測定可能
- マウスを最大3匹同時測定可能 (オプションで5匹まで可)
- 従来のLumina II相当機種

In vivo 発光·蛍光イメージングのスタンダードモデル
- ペルチェ式-90℃冷却CCDカメラ搭載
- 発光と蛍光がどちらも高感度に測定可能
- マウスを最大3匹同時測定可能 (オプションで5匹まで可)
- 近赤外拡張光源、新設計蛍光フィルターを装備

IVIS Lumina S5は、2D発光·蛍光イメージングをハイスループットに測定可能な最新のIn vivoイメージングシステムです。
ユニークな専用設計のアクセサリにより、麻酔下のまま最大5匹のマウスの迅速な薬剤の投与とシームレスな測定が可能です。

IVIS Spectrumは、2Dと3Dの発光·蛍光イメージングを1つのプラットフォームで実現可能な真のIn vivoイメージングシステムです。
Spectrumは、前臨床イメージングの研究開発に必要な超高感度CCDカメラの他、NIST基準のキャリブレータが保証する定量解析に基づく使いやすい専用解析ソフトウェアなどからなり、生きている動物の病気の進行、細胞輸送、遺伝子発現パターンを非侵襲的に長期的にモニタリングするのに最適です。
機種比較
下記の画像をクリックすると、PDFがご覧頂けます。
資料
資料のダウンロードには、ユーザー登録が必要です。
登録がお済みでないお客様は、こちらからユーザー登録をお願いいたします。
Optical imaging detects photons in the visible range of the electromagnetic spectrum. PET and SPECT imaging instruments are...
Aside from the traditional small-molecule chemotherapeutics or targeted therapy agents that have been widely used in the clinic...
Optical-based in vivo imaging of vascular changes and vascular leak is an emerging modality for studying altered physiology in a...
Non-alcoholic fatty liver disease (NAFLD) describes a progressive pathology that affects the liver. Fat accumulation causes fatty...
Amyotrophic lateral sclerosis (ALS) is a devastating neurological disease for which there is no cure. Another lethal brain disease...
Obesity is a global epidemic that is the fifth leading cause of death worldwide and in the US alone, nearly 85% of adults are...
CAR-T therapy has achieved tremendous success in treating blood malignancies, however treating solid tumors with this therapy has...
Researchers trust our in vivo imaging solutions to give them reliable, calibrated data that reveals pathway characterization and...
The need for better profiling is clear, and technological advances are making it possible to optimize clinical trials and...
The next breakthrough therapy could begin here. Our comprehensive drug discovery solutions cover every stage, from target...
Truly understanding infectious diseases is the first step toward containment and eradication. From biology to breakthrough, our...
The goal of in vivo fluorescence molecular imaging is to enable non-invasive visualization and quantification of cellular and...
Researchers are turning to 3D cell cultures, microtissues, and organoids to bridge the translational gap between 2D cell cultures...
Scientists continue to explore several options to treat SARS-CoV-2 infection with hundreds of therapeutics at various phases of...
Proinflammatory cytokine interleukin-2 (IL-2) is of particular interest for cancer immunotherapy as it plays a critical role in...
Spinal muscular atrophy (SMA) is a recessive neuromuscular disease that is caused by loss-of-function mutations in the survival...
A large percentage of Type 2 diabetes mortality is related to cardiovascular complications. Consequently, there is a critical need...
Parkinson’s disease (PD) is a neurodegenerative disorder with progressive worsening of primarily motor symptoms caused by the loss...
The high heterogeneity, lack of tumor-specific targets, and immunosuppressive tumor microenvironment of solid tumors are all...
Annual epidemics of influenza have occurred throughout history causing tens of millions of deaths. Even a run-of-the-mill...
Accumulation of fat in liver cells, a process called steatosis, is a common health problem that has many possible causes...
The most devastating of mosquito diseases, malaria, reached a peak of 241 million cases in the latest analysis from the World...
Adoptive cell transfer using chimeric antigen receptor (CAR-T) cell therapy in which the patient’s T-cells are extracted...
Researchers investigated how a spleen-targeted DNA vaccine, delivered via RBC-hitchhiked nanoparticles, effectively induced robust...
Instrument background occurs when excitation light leaks through the emission filter. This occurs more frequently when the...
This tech note outlines procedures on using auto-exposure on the IVIS® preclinical optical imaging platform using Living Image®...
The ability to image protein-protein interactions (PPIs) in vivo has important implications for a wide variety of biological...
Read how non-invasive optical imaging enables intricate host-pathogen interactions to be visualized and monitored in disease...
As the global population ages and life expectancy increases, neurodegenerative disorders like Alzheimer’s disease (AD) have the...
The primary goal of preclinical imaging is to improve the odds of clinical success and reduce drug discovery and development time...
In vivo fluorescence imaging displays a very broad utility and has become a well-established modality for functional imaging in...
We recently spoke to researchers based at the Centre for Advanced Imaging at the University of Queensland in Australia who have...
There’s a need to propel and reinvigorate the current state of drug discovery pipeline in tackling pressing neurodegenerative...
関連製品
より鮮明な In vivo イメージングデータを取得
IVISbrite発光試薬およびIVISense蛍光試薬の幅広いラインナップは、疾患初期の生物学的変化の解明、疾患進行の追跡、創薬プロセスの最適化、新規治療薬候補の有効性・安全性評価に必要なツールを研究者に提供します。
Revvityが提供するすべての光イメージング試薬、蛍光プローブ、標識試薬、蛍光色素は、業界をリードする IVIS Imaging Systemを用いた多様なイメージングアプリケーションで最適化・検証されています。
IVISbrite 発光基質 & レンチウイルス粒子、および IVISense 蛍光プローブ、標識試薬、蛍光色素を活用し、In vivo イメージング研究に必要な高感度かつ高再現性のデータを取得しましょう。
※研究用途に限ります。診断には使用できません。

関連製品詳細
論文リスト
生物学的プロセスや疾患の進行を追跡、モニタリング、可視化することは、生物学の理解を深めるだけでなく、新薬候補の有効性を開発プロセスの初期段階で評価する上で極めて重要です。
In vivo イメージングは、非侵襲的な方法でリアルタイムに治療薬の前臨床研究を加速させるだけでなく、多様な疾患モデルにおける分子および生理学的研究の理解を深める上でも重要な役割を果たします。
クラス最高の小動物イメージングソリューションで、研究および発見の目標達成をサポートします。基礎研究モデルから臨床応用まで、Revvity社のIVIS Imaging Systemは、がん、感染症、心肺疾患、代謝性疾患などの主要な疾患領域を対象とした27,000報を超える論文が査読付きジャーナルで発表されています。
In vivo 前臨床イメージングは、基礎研究や創薬開発プロジェクトにおいて、より深い知見を得るための最短ルートです。
※研究用途に限ります。診断には使用できません。
トーニングビデオ
In vivo bioluminescence imaging BLI
In vivo fluorescence imaging FLI part 1_Filter Pair Imaging
In vivo fluorescence imaging FLI part 2_Spectral Unmixing
Optical and computed tomography
In vitro bioluminescence imaging BLI
In vitro fluorescence imaging FLI
よくある質問(FAQ)
PDFや資料のダウンロードには、ユーザー登録が必要です。
登録がお済みでないお客様は、こちらからユーザー登録をお願いいたします。
発光に関連したFAQ
光の組織透過性について
一般的に光の組織透過性は、波長と発光している細胞(光源)周辺の生理的な環境(組織)に依存しています。組織は光の吸収と散乱を引き起こす媒体であるため、光が組織を通過する時に400~590nmの青緑色光領域では強く減衰し、590~800nmの近赤外線領域では減衰が少なく、組織を透過しやすいことが知られています。
発光イメージングにおいてよく使用されているホタルのルシフェラーゼは、青色~黄緑色(560~570nm)の波長をピークに持っていますが、発光スペクトラムが広いため、組織透過率の高い600nm以上の光も十分含んでいます。また、現在販売していますBioware Brite細胞株やRediFect Lentiviral Particlesに使用されているRedFlucはLuciola italica由来のホタルルシフェラーゼで、波長において620nmをピークに持つため従来のホタルルシフェラーゼよりも組織透過性に優れています。
IVISは、この組織を透過した非常に微弱な発光においても超高感度CCDカメラによりシグナルをとらえることができます。
![]() In Vivo imaging of light-emitting probes
In Vivo imaging of light-emitting probes
B. W. Rice, M. D. Cable, M. B. Nelson
Journal of Biomedical Optics, October 2001, Vol. 6 No. 4
ルシフェリン1gで何匹のマウス・ラットに投与できますか?
投与量は体重1gあたり、150μgです。マウスの体重を20gと考えると約300匹(回)、ラットの体重200gの場合は約30匹(回)、300gでは約20匹(回)です。
ルシフェリンの希釈方法について
D-Luciferin, Potassium Salt,(1.0g/vial)をダルベッコPBS(Ca2+, Mg2+不含)に溶解し、保存溶液(30mg/mL)を作製する。投与時に150mg/kgとなるように調製してマウスに投与します。
参考資料
![]() ルシフェリン調整方法
ルシフェリン調整方法
ルシフェリンの血中濃度のピーク(時間)はどれぐらいですか?
パーキンエルマー社推奨の濃度を腹腔(i.p.)投与した場合、ルシフェリンの血中動態をみると約15分程でピークとなり、投与の30分後には0近くになっていることからクリアランスタイムは約30分と考えられます。
また、静脈内(iv)投与の場合、投与直後がルシフェリンの血中濃度のピークとなり急速に低下するため、投与後直ちに測定する必要があります。
ルシフェリンの体内分布について
ルシフェリンは血液-脳関門(blood brain barrier)や胎盤なども通過することが確認されており、全身に分布することが知られています。
![]() Cell Uptake and Tissue Distribution of Radioiodine Labelled D-Luciferin: Implication for Luciferase Based Gene Imaging
Cell Uptake and Tissue Distribution of Radioiodine Labelled D-Luciferin: Implication for Luciferase Based Gene Imaging
K.-H. Lee, S. S. Byun, J.-Y. Paik, S. Y. Lee, S. H. Song, Y. S. Choe and B.-T. Kim
Nuclear Medicine Communications, 2003, Vol. 24, 1003-1009/
ルシフェリンの毒性について
ルシフェリンの動物への有害な反応(毒性や免疫学的に)は認められていません。また、連続投与による毒性も認められていません。
ルシフェリンの保存温度について
ルシフェリンの保存温度は-20℃以下を推奨します。ただし調整後分注したものは-20℃以下(遮光下)で小分け保存して、凍結融解は避けてください。
長期保存の場合には、-70℃で保存することを推奨します。この条件で保存すると1年間は安定です。
ルシフェラーゼ遺伝子の発現の強い臓器はありますか?
一般にルシフェラーゼ遺伝子の発現の強弱を決定する第一の因子は、プロモーターの活性の高さです。従いまして、一概にどの臓器で発現が強いとは言えません。
例えばCMVプロモーターを用いたTgマウスでは特に皮膚や精巣で強い発現が見られます。その他には骨、胸腺、脳、脂肪組織などで比較的強い発現が認められています。
動物の体毛の影響はありますか?
体毛による影響はあります。
黒い毛や有色毛などは光を吸収するため、毛を剃るか脱毛剤などで除毛処理したうえで測定することを推奨します。ヌードマウスなどの毛のないマウスでは最もクリアなシグナルが得られます。白い毛(アルビノ)であれば殆どのアプリケーションへの問題はありませんが、微弱なシグナルを測定したいときには剃毛・脱毛を行うとよりシグナルを得やすくなります。
蛍光に関連したFAQ
蛍光たんぱく質・蛍光物質等の選択について
一般的に光の組織透過性は光の波長に強く依存します。(※光の組織透過性ついて参考)
そのため、蛍光イメージングにおいては、励起波長・検出波長ともに600nm以上の光を持つ蛍光たんぱく質や蛍光物質を選択することが重要になります。
GFPやDsRedなどの蛍光たんぱく質を用いた実験系では、励起・検出波長ともに600nm以上の光が少ないため、光の組織透過性が低く、深部のイメージングは難しくなります。ただし、皮下など浅い部位や、解剖した(ex vivo)状態のイメージングであれば検出は可能です。
最近では、iRFPといった近赤外蛍光タンパク質もありますので、それらを用いれば深部の蛍光イメージングも感度よく検出できるようになります。
AddGene:https://www.addgene.org/kits/#fp
蛍光イメージングの際の動物の飼料について
Alexa Fluor 680やCy 5.5に代表される600nm付近の蛍光波長域においては、通常のマウス・ラット用飼料では飼料自体が蛍光を発するため、特に消化管に蛍光シグナルが出やすくなります。
目的とするシグナルが消化管付近に存在する場合には、アルファルファフリーの飼料や合成飼料に実験の1週間前程度からから切り替えることをお薦めします。
装置の性能や解析に関連したFAQ
定量性について
細菌数や腫瘍体積と光の強さの間には非常に良い相関関係が認められています。従いまして、細胞数や腫瘍体積を光の強さに変換した相対的な値による定量が可能です。
測定可能な細胞数は何個ですか?
細胞の種類やベクターなどにもよりますが、in vitroであれば、50個程度から、in vivoでは、約500個から検出可能です。
IVIS Spectrumで測定した場合に、マウス皮下に移植した5個の細胞の発光を検出した例もあり、発現の強度、光源の深度等の条件に依存します。
どのくらいの深さまで検出可能ですか?
プロモーターの種類や活性、光源を取り巻く生理的条件などに因りますが、1~3cmぐらいの深さであれば検出可能です。マウスの場合、各臓器のシグナルを観察することは十分可能です。
またラットでも動物を装置にセットする際に仰向け、うつ伏せ等位置を変えることにより観察可能になります。
IVISのイメージング測定時間はどのように決めたらいいですか?
生体測定時の目安として1回の測定あたりの発光イメージングは1min、蛍光イメージングは5~10secとなります。測定サンプルのシグナルの強さにより測定時間は異なります。
最適なExposure timeがわからない場合は、Exposure TimeメニューからAutoを選択することも可能です。
Spectrum-CTでCT撮影した場合、マウスへの被ばく量はどのくらいですか?
使用する撮影モードにより撮影条件、時間が異なるため被ばく量も異なりますが、13mGy~となります。
IVISにおける定量について(発光)
関心領域を数値化したい場合は、ソフトウェア(Living Image)上でROIというツールを使用し、数値化したい領域を定めます。定量の単位として、発光ではTotal Flux※1とAverage Radiance※2があります。
※1 Total Flux:光源の光度つまり光の強さ(単位はphotons/sec)。
※2 Average Radianc:光源から放射された皮膚表面における輝度の平均値(単位はphotons/sec/cm2/sr、srはステラジアン;立体角の略)
値がマイナスになっている
数値化した際にバックグラウンド部分でマイナス値が出ることがあります。
通常、夜間実施しているCCDカメラのオートバックグラウンドにより値が補正されたことに由来しており、”0”と考えて問題ありません。
ファイルが開かない
データを読み込む際のディレクトリ内に日本語などの全角2バイト文字が含まれている場合はデータの読み込みができません。ファイル名を半角英数字に変更して読み込み直すか、ファイルの場所を変更して読み込みができるかご確認ください。
その他のFAQ
Living Imageソフトウェアについて
IVIS Imaging Systemを新規にご購入された場合、現在の最新バージョンはライセンスフリーになります(※従前は5ライセンスまで)詳細は弊社までお問合せください。
最新版のLiving Imageソフトウェアのダウンロードは、米国Revvity社のWebサイトよりダウンロードが可能です。
他のModalityとの重ね合わせは出来ますか?
可能です。
MultiModality kitを使う事でリガク社CT装置(R_mCT2, Cosmoscanシリーズ)とはマウスの体位を動かさないまま自動重ね合わせが出来ます。また、DICOM形式のデータであれば読み込みが可能なため、PET装置(G4/G8)など他のモダリティとのデータの重ね合わせも可能です。
装置のメンテナンスや不具合等に関するFAQ
日常の点検について
使用前に、カメラおよびステージ温度の確認、オートバックグラウンドが実行されているか、麻酔装置への活性炭フィルターの接続、活性炭フィルターの重量測定を行ってください。活性炭フィルターは、必要あれば(初期重量から指定された重量より増加した場合)交換を行ってください。使用後は、装置内ステージや麻酔装置付属のマウスチャンバーの清掃を行ってください。
日常の点検に加え、エンジニアによる年1回の定期メンテナンスを行うことを推奨します。
装置内部の清掃について
スプレーでの噴霧は避け、内部の清掃は拭取りで行ってください。70%エタノールのほか、3.4%グルタールアルデヒド、1.56%フェノール、3~5%漂白剤(脱イオン水で希釈)も使用可能です。清掃時は水分が内部に滞留しない様換気を十分に行ってください。
ガス麻酔システムの麻酔用フィルターの交換時期について
未使用状態で重量を測定していただき、定期的に重量を測定してください。指定の重量※以上になったら新しいフィルターと交換してください。
※ XGI-8用麻酔フィルターの場合、50g増加したら交換が必要です。
マウス逃亡時の対処方法について
Living Imageが立ち上がっている状態でマウスが逃亡した場合:
卓上型のIVIS装置(Lumina系)でマウスが逃亡した場合はコントロールパネルでFOV:Aを選択し、ステージを一番上まで上げます。次にステージの黒いシートがはまっているねじを外し、ロールシートを外したら、マウスを捕まえます。
自立型のIVIS装置(Spectrum系)の場合はコントロールパネルのServiceボタンをクリックし、ステージを一番上まで上げたら、ステージ手前にあるつっかえ棒を引き出して入口の部分にストッパーとして止めた上でマウスを捕まえます。
Living Imageが立ち上がっておらず、マウス逃亡からしばらく経過している場合:
マウスを取り出せるようであればソフトウェアを立ち上げてイニシャライズ後に上記手順にて取り出してください。
参考資料
![]() マウス救出手順書
マウス救出手順書
電源が入らない・PCが立ち上がらない
エンジニアまでご連絡ください。
横浜サポートセンター:045-508-2171、本社:03-5220-1520
もしくは biosupport@summitpharma.co.jp
イニシャライズができない
Logファイル(以下)を入手してエンジニアまでご連絡ください。
(C:\Program Files\Caliper Life Sciences\Living Imageフォルダのliactivit.logおよびliactivit.bakファイル)
その間、ソフトウェアを一旦閉じてPCのシャットダウンと装置のスイッチをオフにした後、1分程待ってから再度立ち上げて様子を見てください。
アラーム音が鳴っている
UPSもしくは装置やPCのいずれのアラームが鳴っているか特定してエンジニアまでご連絡ください。
カメラが冷えない
一般的にはカメラの冷却能力の低下が考えられます。Spectrumシリーズの場合は冷却液の欠乏やチラーの故障も考えられますので、Control PanelのTemperature Boxからカメラ温度を確認してエンジニアにご連絡ください。
また冷却機構に過負荷がかりますので、すぐに使用しない場合は、装置全体の電源を落としていただくようお願いいたします。
その他不具合がございましたら
具体的な状況をエンジニアまでご連絡ください。
横浜サポートセンター:045-508-2171、本社:03-5220-1520
もしくは biosupport@summitpharma.co.jp
不具合の状況が確認できる画像、エラーメッセージやカメラインフォ等のファイルを送付する場合は、メールでご連絡ください。